
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния реального газа
|
|
До сих пор, говоря о газе, мы подразумевали идеальный газ, состояние которого описывается уравнением Менделеева-Клапейрона 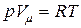 , где
, где 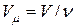 - молярный объем. Однако, опыт показывает, что данное уравнение далеко не всегда точно описывает свойства реальных газов. На деле
- молярный объем. Однако, опыт показывает, что данное уравнение далеко не всегда точно описывает свойства реальных газов. На деле  , причем отличие величины
, причем отличие величины 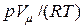 , называемой коэффициентом сжимаемости газа, от единицы возрастает с увеличением давления газа (при неизменной температуре). Например, при давлении
, называемой коэффициентом сжимаемости газа, от единицы возрастает с увеличением давления газа (при неизменной температуре). Например, при давлении 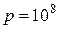 Па (или»1000 атмосфер[21])
Па (или»1000 атмосфер[21]) 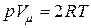 . Иначе говоря, чем выше давление газа, тем хуже он сжимается.
. Иначе говоря, чем выше давление газа, тем хуже он сжимается.
Существуют две причины того, что модель идеального газа плохо описывает свойства реальных газов при высоких давлениях. Во-первых, в модели идеального газа предполагается, что собственный объем молекул много меньше объема сосуда, занимаемого газом. Это предположение можно считать верным при нормальных условиях, когда объем молекул составляет менее 0,1% объема сосуда, однако при давлении 100 атм сами молекулы занимают уже примерно 70% объема сосуда!
Во-вторых, в модели идеального газа считается, что молекулы не взаимодействуют друг с другом на расстоянии. Эксперименты показывают, что это условие хорошо выполняется, когда расстояние между центрами молекул превышает 10-9 м, что соответствует концентрации молекул порядка 1027 м-3. При бóльших концентрациях пренебрегать силами межмолекулярного взаимодействия нельзя. В действительности взаимодействие между молекулами носит сложный характер – на малых расстояниях (~ 10-10 м) они отталкиваются, на бóльших – притягиваются. Характерная зависимость Энергии взаимодействия U вз между двумя молекулами от расстояния r между их центрами показана на рисунке 5.1. При 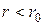 молекулы отталкиваются, при
молекулы отталкиваются, при 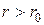 - притягиваются.
- притягиваются.
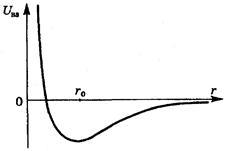
Рис. 5.1
Обе причины, не позволяющие адекватно описывать свойства реального газа при помощи уравнения Менделеева-Клапейрона, можно устранить, введя в него соответствующие поправки, что и сделал в 1873 году голландский физик Ван-дер-Ваальс[22]. Уравнение, полученное Ван-дер-Ваальсом и носящее его имя, имеет следующий вид:
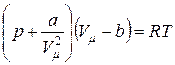 . (5.1)
. (5.1)
Постоянные а и b в уравнении (5.1) называются постояннымиВан-Дер-Ваальса. Значения постоянных а и b для некоторых газов приведены в таблице 5.1.
Таблица 5.1
| Газ | а, Па×м6/моль2 | b, 10-6 м3/моль | d, нм |
| Н2 | 0,024 | 0,27 | |
| N2 | 0,137 | 0,37 | |
| O2 | 0,137 | 0,35 | |
| H2O | 0,554 | 0,30 |
Поправка 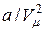 в первой скобке уравнения Ван-дер-Ваальса имеет размерность давления и называется внутренним давлением. Эта поправка описывает действие сил межмолекулярного взаимодействия. Смысл ее в том, что благодаря притяжению молекул друг к другу сила, с которой они действуют на стенку сосуда, уменьшается. Если бы силы межмолекулярного притяжения вдруг исчезли, давление на стенку сосуда возросло бы и стало бы равно
в первой скобке уравнения Ван-дер-Ваальса имеет размерность давления и называется внутренним давлением. Эта поправка описывает действие сил межмолекулярного взаимодействия. Смысл ее в том, что благодаря притяжению молекул друг к другу сила, с которой они действуют на стенку сосуда, уменьшается. Если бы силы межмолекулярного притяжения вдруг исчезли, давление на стенку сосуда возросло бы и стало бы равно 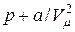 .
.
Поправка b характеризует собственный объем молекул газ. Ее размерность метр кубический на моль (м3/моль). Можно показать, что
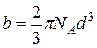 ,
,
где d – эффективный диаметрмолекулы [23] (см. таблицу 5.1).
Задача 5.1. Давление кислорода р равно 7 МПа, его плотность 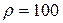 кг/м3. Найти температуру кислорода.
кг/м3. Найти температуру кислорода.
Date: 2015-05-08; view: 927; Нарушение авторских прав