
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение. Обозначим давление, объем и температуру газа в начальном состоянии p1, V1, T1, в конечном – p2, V2, T2
|
|
Обозначим давление, объем и температуру газа в начальном состоянии p 1, V 1, T 1, в конечном – p 2, V 2, T 2. По условию задачи 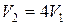 . Поскольку
. Поскольку 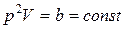 , то
, то 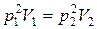 , отсюда
, отсюда 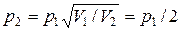 . Согласно уравнению Клапейрона (1.10)
. Согласно уравнению Клапейрона (1.10)
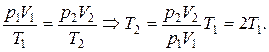
Итак, температура увеличилась в два раза.
Исторически уравнения Клапейрона (1.10) и Клапейрона-Менделеева (1.9) были получены в результате обобщения ряда газовых законов, открытых экспериментально на протяжении XVII – первой половины XIX веков. Прежде всего, это знакомые Вам по школьному курсу физики законы, описывающие изопроцессы (т.е. процессы, протекающие при неизменном количестве вещества и постоянном давлении, объеме или температуре).
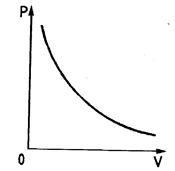
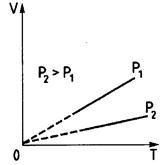
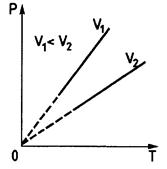
Рис. 1.4 Рис. 1.5 Рис. 1.6
Изотермический процесс. Процесс изменения состояния макроскопической системой называется изотермическим, если он протекает при постоянной температуре. Закон, описывающий изотермический процесс в идеальном газе носит название закона Бойля [10] -Мариотта [11]: для газа неизменной массы при неизменной температуре произведение давления на объем является постоянной величиной:
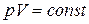 при
при 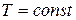 . (1.11)
. (1.11)
Из уравнения (1.11) видно, что при постоянной температуре давление газа обратно пропорционально его объему. Поэтому изотерма (т.е. зависимости 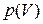 при
при 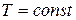 ) в координатах (p,V) будет изображаться гиперболой (рис. 1.4).
) в координатах (p,V) будет изображаться гиперболой (рис. 1.4).
Изобарный процесс. Процесс изменения состояния макроскопической системы называется изобарным (или изобарическим), если он происходит при постоянном давлении. Закон, описывающий изобарный процесс в идеальном газе носит имя Гей-Люссака [12]: при неизменной массе газа и постоянном давлении отношение объема к температуре есть величина постоянная:
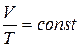 при
при 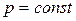 . (1.12)
. (1.12)
Из уравнения (1.12) следует, что при постоянном давлении объем газа прямо пропорционален его температуре: 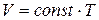 . Графически эта зависимость изображается прямой, называемой изобарой (рис. 1.5).
. Графически эта зависимость изображается прямой, называемой изобарой (рис. 1.5).
Изохорный процесс. Изохорным (или изохорическим) называется процесс изменения состояния макросистемы, протекающий при постоянном объеме. Закон, описывающий изменение состояния идеального газа в изохорном процессе был открыт французским физиком Ж.Шарлем[13] и носит его имя. З акон Шарля: при неизменной массе газа и постоянном объеме отношение давления к температуре есть величина постоянная:
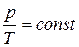 при
при 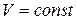 . (1.13)
. (1.13)
Из уравнения (1.13) следует, что при неизменном объеме давление газа прямо пропорционально его температуре: 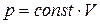 . Соответствующая зависимость графически изображается прямой, называемой изохорой (рис. 1.6).
. Соответствующая зависимость графически изображается прямой, называемой изохорой (рис. 1.6).
Сформулируем еще три закона, описывающие свойства идеальных газов.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях содержится одно и то же число молекул.
Закон Дальтона [14]: давление смеси идеальных газов равно сумме парциальных давлений газов, входящих в ее состав. (Парциальным называется давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре).
Закон Лошмидта [15]: в 1 см3 любого идеального газа при нормальных условиях содержится одинаковое число молекул (число Лошмидта), равное  см-3.
см-3.
Легко убедиться, что все приведенные выше экспериментальные газовые законы можно вывести из уравнения Клапейрона-Менделеева (1.9). Проделайте это самостоятельно в качестве упражнения.
Date: 2015-05-08; view: 1318; Нарушение авторских прав