
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные термины и понятия
|
|
Электрохимические процессы – это гетерогенные ОВР, в которых происходит перенос заряда и вещества через поверхность раздела фаз. Они сопровождаются взаимным превращением химической и электрической энергии. В гальванических элементах энергия химической реакции преобразуется в электрическую. В процессах электролиза пропускание электрического тока через водный раствор вызывает химические реакции. Эти устройства состоят из двух электродов, замкнутых в единую цепь проводником 1-го рода и проводником 2-го рода.
Электрод – это гетерогенная система, представляющая собой проводник 1-го рода (чаще всего металл, обладающий электронной проводимостью), погруженный в раствор электролита.
В электрохимии электрод, на котором идут окислительные процессы, называют анодом. Электрод, на котором идут восстановительные процессы, называют катодом.
В металлической решетке существует подвижное равновесие:
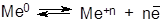
где Ме0 – атом металла, Ме+n – катион металла, n – заряд катиона и число отданных электронов (см. рис. ниже).
Если поместить металл в воду, то под действием полярных молекул (диполей) воды часть катионов металла переходит с его поверхности в водную среду, в которой они существуют в гидратированном (сольватированном) состоянии (уравнение 8.1):
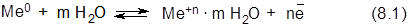
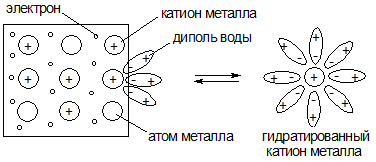
В результате этого процесса на поверхности металла возникает избыток электронов, поэтому она заряжается отрицательно.
Некоторая часть гидратированных катионов металла находится в объеме водной фазы за счет стабилизирующей гидратной оболочки. Однако их большая часть за счет электростатического притяжения находится у поверхности металла, формируя двойной электрический слой (ДЭС) в виде плоского конденсатора. В результате между металлом и раствором возникает разность потенциалов:
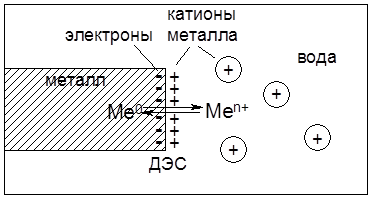
При установлении в данной системе равновесия, которое характеризуется определенным значением концентраций электронов на поверхности электрода и катионов металла в растворе, возникает разность потенциалов, которую называют электродным потенциалом металла и обозначают ЕMe0/Меn+, В.
По способности катионов металла переходить в раствор электролита все металлы делятся на активные, средней активности и неактивные.
Металлы, в соответствии с величинами их электрохимической активности, образуют электрохимический ряд напряжений металлов, в котором приведены значения их стандартных электродных потенциалов (с.э.п.). С.э.п. – это разность потенциалов, возникающая между нормальным водородным электродом (его потенциал условно принят равным нулю) и электродом из данного металла, находящегося в стандартных условиях: металл погружен в раствор собственной соли с концентрацией его катионов 1 моль на 1000 г воды при 298 К.
В ряду напряжений к активным относятся металлы от Li до Fe, к металлам средней активности – стоящие между Fe и H2, к неактивным – стоящие правее водорода.
Величина электродного потенциала металла зависит не только от его природы, но и от концентрации его катионов в растворе и температуры.
Зависимость электродного потенциала от концентрации катионов металла в растворе выражается уравнением Нернста:
Ес= Е0 + 0,059/n . lgСm
где Сm – моляльная концентрация катионов металла в растворе (моль/1000 г воды);
n – заряд катиона металла;
Ео – стандартный электродный потенциал данного металла, В;
Ес – потенциал металла при концентрации его катионов, не равной 1, В.
Таким образом, если увеличивать концентрацию катионов металла, то, согласно принципу Ле-Шателье, равновесие в уравнении 8.1 смешается влево. При этом отрицательный заряд металла уменьшается, поэтому его электродный потенциал становится менее отрицательным.
Рекомендуемая литература по теме 8: [1] гл. 9, §§ 9.3, 9.4, 38.5; [2], гл. 9, §§ 9.2, 9.3, гл. 10; [3], гл. 8, §§ 5, 6; [4], гл. 10, §§ 4-6, гл. 11, §§ 1-5.
Лабораторная работа № 8.1 Составление гальванического элемента с концентрационной поляризацией и определение его ЭДС (с элементами УИРС)
Теория электродных потенциалов позволила объяснить процессы, происходящие в химических источниках электрической энергии – гальванических элементах. Гальваническим элементом (ГЭ) называют электрохимическую систему, производящую электрическую энергию за счет протекания в ней окислительно- восстановительной реакции.
Наиболее распространенными являются ГЭ, составленные из электродов-полуэлементов – двух разных металлов, погруженных в растворы собственных солей. Простейшим ГЭ этого типа является элемент Якоби- Даниэля:
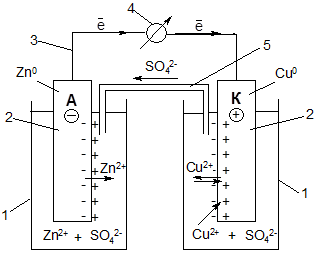
1 – химический стакан с раствором электролита;
2 – электроды цинковый и медный;
3 – соединительные провода;
4 – вольтметр;
5 – электролитический ключ (сифонная трубка).
Цель работы: практическое ознакомление с устройством и принципом работы гальванического элемента (ГЭ), методикой расчета и измерения его ЭДС.
Вследствие различия электрохимической активности металлов, входящих в состав электродов, или разной концентрации электролита в ГЭ возникает электродвижущая сила (ЭДС). ЭДС рассчитывается по формуле:
ЭДС = Е0 катода – Е0 анода, В
Если ГЭ не находится в стандартных условиях, то сначала находят значения потенциалов электродов в данных условиях по формуле Нернста (с. 17), а затем вычисляют ЭДС.
В процессе работы ГЭ его ЭДС постепенно уменьшается. Это явление называется поляризацией, оно связано с изменением значений электродных потенциалов элемента во времени. Поляризация бывает концентрационной и химической. Концентрационная поляризация делится на анодную и катодную. При анодной поляризации потенциал анода со временем становится более положительным, это объясняется следующим:
1) электроны движутся от анода к катоду быстрее, чем катионы металла выходят из анода в раствор;
2) концентрация катионов металла в прианодном пространстве постоянно увеличивается, что препятствует их выходу из анода.
При катодной поляризации потенциал катода становится все более отрицательным по следующим причинам:
1) электроны поступают от анода к катоду быстрее, чем катионы металла восстанавливаются на катоде;
2) концентрация катионов металла в прикатодном пространстве постоянно уменьшается.
Для борьбы с концентрационной поляризацией к растворам электролитов добавляют деполяризаторы, которые тормозят процесс изменения электродных потенциалов. Например, для устранения катодной поляризации добавляют различные окислители (О2, MnO2, K2Cr2O7 и др.).
Химическая поляризация возникает, когда в ходе работы г.э. изменяется природа поверхности электродов, что также приводит к изменению их потенциалов.
Реактивы: растворы сульфата цинка ZnSO4 и сульфата меди CuSO4 следующих концентраций: 1 моль /1000 г Н2О, 0,1 моль/1000 г Н2О, 0,01 моль/1000 г Н2О, 0,001 моль/1000 г Н2О.
Посуда и материалы: лабораторный гальванический элемент Якоби-Даниэля, состоящий из двух толстостенных стаканов на 200 см3, электроды цинковой и медной пластинок в качестве электродов, соединительных проводов, потенциометра и сифонной трубки – U-обра-
зной стеклянной трубки, заполненной проводящим электрический ток насыщенным раствором.
Date: 2015-05-08; view: 1039; Нарушение авторских прав