
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа № 8.3 Электролиз растворов электролитов
|
|
Цель работы: ознакомление с процессами, протекающими на нерастворимых и растворимых электродах, при электролизе водных растворов электролитов и вторичными процессами при электролизе.
Электролизом называют гетерогенный окислительно-восстановительный процесс, происходящий на электродах в растворах или расплавах электролитов под действием внешнего источника тока. Для осуществления электролиза:
– к отрицательному полюсу внешнего источника электричества подключают электрод, на котором будет происходить процесс восстановления (этот электрод, имеющий отрицательный заряд, называют катодом);
– к положительному полюсу внешнего источника электричества подключают электрод, на котором будет происходить процесс окисления (этот электрод, имеющий положительный заряд, называют анодом);
– электроды предварительно погружают в водный раствор (или расплав) электролита.
Ячейку для электролиза, состоящую из двух электродов, погруженных в раствор (расплав) электролита, называют электролизером.
Продукты окисления – восстановления или поглощаются на поверхности электродов (металлы), или выделяются в виде газов, или вступают в реакцию между собой и с другими веществами, находящимися в растворе, образуя вторичные продукты электролиза.
Процессы, протекающие в ходе электролиза на поверхности анода и катода, определяются свойствами электролита, растворителя и материала электрода.
Аноды бывают следующих типов:
– инертные аноды, которые изготавливают из химически инертного материала (платина, графит);
– растворимые аноды (Cu, Ag, Zn, Cd и др.), которые при электролизе разрушаются (переходят в раствор в виде катионов).
При электролизе расплавов в окислительно-восстановительных процессах участвуют только частицы данного электролита. На катоде восстанавливаются его катионы, а на аноде окисляются анионы.
При электролизе водных растворов электролитов в окислительно-восстановительных процессах на электродах участвуют не только ионы электролита, но и ионы воды.
Порядок разрядки катионов у катода: На катоде (К-) в первую очередь восстанавливаются катионы с более положительным электродным потенциалом, обладающие большей окислительной способностью (стоящие после водорода в ряду напряжений).
При электролизе водных растворов солей активных металлов, стоящих в ряду напряжений от Li до Al включительно, на катоде восстанавливаются ионы водорода, а начиная с марганца – катионы самих металлов.
Порядок разрядки анионов у анода: На аноде в первую очередь окисляются анионы с меньшим электродным потенциалом, обладающие большей восстановительной способностью (табл. 8.5).
Таблица 8.5 – Стандартные электродные потенциалы анионов, В
| 2I- / I2 | 2Br- / Br2 | 2Cl- / Cl2 | 2H2O / 2OH-+2H+ | SO42- / S2O82- | 2F- / F2 |
| +0,53 | +1,06 | +1,36 | +1,77 | +2,05 | +2,85 |
При электролизе водных растворов солей бескислородных кислот (кроме фтористоводородной) на аноде окисляются кислотные остатки, а при электролизе растворов солей кислородсодержащих кислот – гидроксид-анионы (OH –) из воды.
Ниже рассмотрены примеры записи процессов электролиза:
Пример 1. Электролиз водного раствора Na2SO4 на инертных (угольных) электродах.
В растворе сульфата натрия присутствуют ионы Na+ и SO4-2 и молекулы воды.
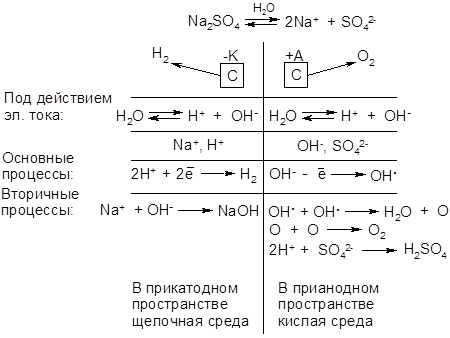 |
В соответствии с последовательностью разрядки ионов на катоде и на аноде проходят следующие процессы:
Таким образом, при электролизе раствора Na2SO4 на катоде выделяется водород, а на аноде – кислород. Вблизи катода образуется раствор щелочи NaOH, а вблизи анода – раствор H2SO4. Если катодное и анодное пространство отделены перегородкой, то можно получить все продукты электролиза в соответствии с уравнением
2Na2SO4 + 6H2O = 2H2↑ +O2↑+4NaOH + 2H2SO4.
Пример 2. Электролиз водного раствора CuSO4 с медным (растворимым) анодом.
Из раствора сульфата меди на катоде могут восстанавливаться ионы Cu2+ (E0Cu = +0,34 B) и молекулы воды (E0H2O = -0,84 B). Большей окислительной способностью обладают ионы меди, поэтому они восстанавливаются в первую очередь.
На аноде возможны следующие процессы:
2SO42- – 2ē = S2O42- E1 = +2,05 B;
2H2O – 4ē = O2 + 4H+ E2 = +1,23 B;
Cu0 – 2ē = Cu2+ E3 = +0,34 B.
При сравнении окислительно-восстановительных потенциалов этих процессов видно, что потенциал медного анода имеет меньшее значение, следовательно, на аноде окисляется медь, т.е. материал самого анода.
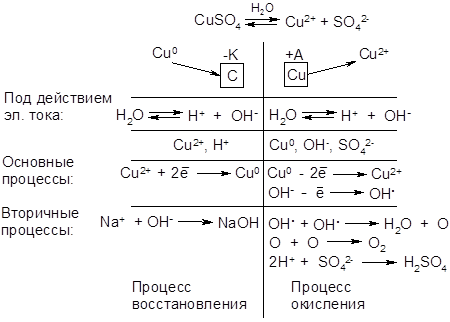 |
Процесс электролиза в этом случае сводится к выделению меди на катоде и постоянному растворению медного анода.
Date: 2015-05-08; view: 4685; Нарушение авторских прав