
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Зміщення стану рівноваги. Принцип Ле-Шательє
|
|
Рівновага є динамічним процесом, бо вона зумовлена одночасним протіканням процесів у двох протилежних напрямах з однаковою швидкістю.
Зміна одного з факторів, що визначають рівноважний стан, порушує рівновагу. Згодом система самодовільно, без затрати роботи, переходить з нерівноважного стану в рівноважний.
Напрямок переходу системи з нерівноважного стану в рівноважний, тобто зміщення рівноваги залежно від зміни зовнішніх умов, визначається принципом Ле-Шательє: якщо змінити одну з умов, при яких система перебуває в стані рівноваги, то рівновага зміщується в напрямі того процесу, який протидіє зробленій зміні.
При підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, а при зниженні температури – в бік процесу, що протікає з виділенням теплоти.
При збільшенні тиску рівновага зміщується в бік меншого об'єму, тобто в бік утворення меншого числа моль газів, а при зменшенні тиску – в бік утворення більшого числа моль газів.
При збільшенні концентрації однієї з початкових (вихідних) речовин рівновага зміщується в бік утворення кінцевих речовин (продуктів), а при зменшенні концентрації вихідної речовини – в бік утворення початкових речовин.
Наприклад, для реакції одержання карбіду заліза
3Fe(т) + 2СО(г) = Fe3C(т) + СО2(г),
що проходить з виділенням теплоти (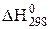 = -149,84 кДж), при підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, тобто ліворуч. Підвищення загального тиску зміщує рівновагу реакції в бік утворення СО2, тобто праворуч. І навпаки.
= -149,84 кДж), при підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, тобто ліворуч. Підвищення загального тиску зміщує рівновагу реакції в бік утворення СО2, тобто праворуч. І навпаки.
Для реакції одержання міді
2Cu2O(т) + Cu2S(т) = 6Сu(т) + SO2(г),
що відбувається з поглинанням теплоти (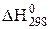 = 128,96 кДж), підвищення температури зміщує рівновагу в бік протікання ендотермічного процесу, тобто праворуч. Збільшення загального тиску зміщує реакцію в бік меншого числа моль газів, тобто ліворуч. І навпаки.
= 128,96 кДж), підвищення температури зміщує рівновагу в бік протікання ендотермічного процесу, тобто праворуч. Збільшення загального тиску зміщує реакцію в бік меншого числа моль газів, тобто ліворуч. І навпаки.
Якщо число моль газоподібних речовин у вихідних і кінцевих речовин однакове, зміна тиску не призведе до зміщення рівноваги реакції.
Date: 2015-05-08; view: 568; Нарушение авторских прав