
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ван-дер-ваальсовский газ
|
|
В п.1.8 отмечалось, что поведение реальных газов хорошо описывается уравнением
pVM =RT. (1.67)
 только при малых плотностях, т. е. при не слишком больших давлениях и достаточно высоких температурах (см. (1.22)). С повышением давления и уменьшением температуры наблюдаются значительные отступления от уравнения. Во втором столбце: табл.1.2 приведены значения произведения pV для массы азота, занимающей при нормальных условиях объем, равный одному литру. Указанные значения даны для различных давлений и одной и той же температуры 0°С.
только при малых плотностях, т. е. при не слишком больших давлениях и достаточно высоких температурах (см. (1.22)). С повышением давления и уменьшением температуры наблюдаются значительные отступления от уравнения. Во втором столбце: табл.1.2 приведены значения произведения pV для массы азота, занимающей при нормальных условиях объем, равный одному литру. Указанные значения даны для различных давлений и одной и той же температуры 0°С.
| P, атм | РV, атм×л |
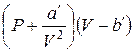 , атм×л , атм×л
|
| 1,000 | 1.000 | |
| 0.994 | 1.000 | |
| 1,048 | 1,009 | |
| 1.390 | 1,014 | |
| 2,069 | 0,893 |
В соответствии с уравнением (1.67) произведение pV при неизменной температуре должно оставаться постоянным. В действительности, как видно из таблицы, при давлениях порядка 200 атм наблюдаются заметные отклонения, которые, непрерывно возрастая с увеличением давления, достигают при 1000 атм более 100%.
Эти отклонения не представляются удивительными, поскольку при увеличении плотности начинают играть все большую роль объем молекул и взаимодействие между ними.
Для описания поведения газов в широком интервале плотностей было предложено много различных уравнений. Самым простым из них и вместе с тем дающим достаточно хорошие результаты оказалось уравнение Ван-дер-Ваальса. Это уравнение получено путем внесения поправок в уравнение (1.67) и имеет следующий вид:
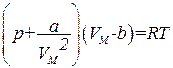 , (1.68)
, (1.68)
где p — давление, оказываемое на газ извне (равное давлению газа на стенки сосуда), а и b — константы Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. Если давление выражено в паскалях, а объем— в кубических метрах на моль, то константа а измеряется в Па×м6/моль2, а константа b — в м3/моль. Иногда константу а выражают в атм·л2/моль2 , а константу b — в л/моль.
Из-за взаимного притяжения между молекулами газ как бы сжимается большим давлением, чем давление p, оказываемое на газ стенками сосуда, в котором он заключен. Поправка  характеризует ту добавку к внешнему давлению, которая обусловлена взаимным притяжением молекул друг к другу. Заметное воздействие молекул друг на друга осуществляется в пределах небольших расстояний, называемых радиусом молекулярного действия. Сила взаимного притяжения двух элементарных объемов, имеющих размеры порядка этого радиуса, пропорциональна как числу молекул заключенных в одном из объемов, так и числу молекул, заключенных в другом объеме. Каждое из этих чисел в свою очередь пропорционально числу молекул в единице объема, т.е. обратно пропорционально объему газа. Этими соображениями можно пояснить то обстоятельство, что поправка к давлению в (1.68) имеет вид
характеризует ту добавку к внешнему давлению, которая обусловлена взаимным притяжением молекул друг к другу. Заметное воздействие молекул друг на друга осуществляется в пределах небольших расстояний, называемых радиусом молекулярного действия. Сила взаимного притяжения двух элементарных объемов, имеющих размеры порядка этого радиуса, пропорциональна как числу молекул заключенных в одном из объемов, так и числу молекул, заключенных в другом объеме. Каждое из этих чисел в свою очередь пропорционально числу молекул в единице объема, т.е. обратно пропорционально объему газа. Этими соображениями можно пояснить то обстоятельство, что поправка к давлению в (1.68) имеет вид 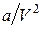 . Вследствие того, что молекулы обладают конечным объемом, пространство, доступное для движения молекул, оказывается меньшим, чем объем сосуда V M. Поправка b в (1.68) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в моле газа.
. Вследствие того, что молекулы обладают конечным объемом, пространство, доступное для движения молекул, оказывается меньшим, чем объем сосуда V M. Поправка b в (1.68) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в моле газа.
Уравнение (1.68) написано для одного моля газа. Чтобы перейти к уравнению для произвольной массы т, нужно учесть, что 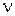 молей газа при тех же условиях занимают в
молей газа при тех же условиях занимают в  раз больший объем: V= n V м.
раз больший объем: V= n V м.
Заменив в (1.68) V м через V/ n, получим
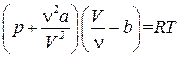 .
.
Умножив это уравнение на v, и, введя обозначения
а'= n 2a, b'= n b, (1.69)
приходим к уравнению Ван-дер-Ваальса для v молей
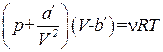 . (1.70)
. (1.70)
Буквами 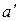 и
и  обозначены константы Ван-дер-Ваальса для v молей. Их связь с а и b дается соотношениями (1.69). Константа а' измеряется в Па×м6, константа b' имеет размерность объема. Насколько уравнение Ван-дер-Ваальса лучше передает поведение газов, чем уравнение (1.67), можно судить по данным, приведенным в табл. 1.2. В третьем столбце таблицы даны значения величины
обозначены константы Ван-дер-Ваальса для v молей. Их связь с а и b дается соотношениями (1.69). Константа а' измеряется в Па×м6, константа b' имеет размерность объема. Насколько уравнение Ван-дер-Ваальса лучше передает поведение газов, чем уравнение (1.67), можно судить по данным, приведенным в табл. 1.2. В третьем столбце таблицы даны значения величины 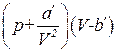 [10] для той же массы азота, для которой даны во втором столбце значения рV. Как видно из таблицы, уравнение Ван-дер-Ваальса гораздо лучше согласуется с экспериментом, чем уравнение (1.67).
[10] для той же массы азота, для которой даны во втором столбце значения рV. Как видно из таблицы, уравнение Ван-дер-Ваальса гораздо лучше согласуется с экспериментом, чем уравнение (1.67).
В соответствии с тем фактом, что все реальные газы с уменьшением плотности приближаются по своим свойствам к идеальному газу, уравнение Ван-дер-Ваальса в пределе, при стремлении объема к бесконечности, переходит в уравнение (1.67). В этом можно убедиться, вынеся в уравнении (1.70) р и V за скобки
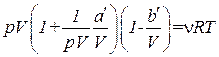
и приняв во внимание, что произведение pV остается примерно постоянным.
Реальные газы следуют уравнению Ван-дер-Ваальса лишь приближенно. Воображаемый газ, точно подчиняющийся уравнению (1.68), называется Ван-дер-ваальсовским.
Внутренняя энергия Ван-дер-ваальсовского газа должна включать в себя, кроме кинетической энергии молекул, энергию взаимодействия между молекулами. Для нахождения внутренней энергии Ван-дер-ваальсовского газа воспользуемся тем обстоятельством, что работа, совершаемая при расширении газа, против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия: d'A=dEp. Силы взаимного притяжения между молекулами учтены в уравнении (1.68) с помощью добавки к давлению, равной a/V2 М Соответственно работа против сил взаимодействия между молекулами может быть представлена в виде 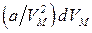 (подобно этому работа, совершаемая газом против внешних сил, определяется выражением РdV). Таким образом,
(подобно этому работа, совершаемая газом против внешних сил, определяется выражением РdV). Таким образом,
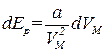 .
.
Интегрирование этого выражения дает, что
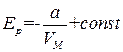 . (1.71)
. (1.71)
Внутренняя энергия ван-дер-ваальсовского газа зависит как от объема, так и от температуры. Следовательно, выражение для U м имеет вид:


(мы включили const выражения (1.69) в f(T)). Это выражение в пределе при стремлении объема к бесконечности должно переходить в выражение (1.28) для внутренней энергии идеального газа. Следовательно, f(T)=СVT.
Итак, внутренняя энергия моля ван-дер-ваальсовского газа определяется формулой
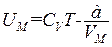 . (1.72)
. (1.72)
Внутренняя энергия 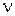 молей будет в
молей будет в 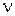 раз больше:
раз больше:
 (1.73)
(1.73)
(мы учли, что v2a=a' и vV м =V). По формулам (1.72) и (1.73) можно находить приближенные значения внутренней энергии реальных газов.
Date: 2015-05-05; view: 1045; Нарушение авторских прав