
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задачи по разделам термодинамики
|
|
Уравнения состояния идеального и реального газа
1. Определить плотность и удельный объем метана при нормальных и стандартных физических условиях, а также при давлении 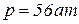 и температуре
и температуре 
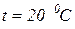 , используя уравнения состояния идеального и реального газа. Сопоставить и проанализировать полученные результаты (ПРИЛОЖЕНИЕ).
, используя уравнения состояния идеального и реального газа. Сопоставить и проанализировать полученные результаты (ПРИЛОЖЕНИЕ).
2. В баллоне объемом 40 л находится азот под давлением 75 бар и имеет температуру 20 0С. Пользуясь уравнениями состояния идеального и реального газа, определить плотность газа и сравнить полученные результаты (ПРИЛОЖЕНИЕ).
3. Определить массовый и объемный расход природного газа при давлении 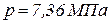 и температуре
и температуре 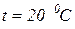 , если его коммерческий расход составляет
, если его коммерческий расход составляет 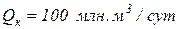 . Молярная масса газа равна
. Молярная масса газа равна 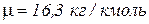 , а значение его коэффициента сжимаемости составляет
, а значение его коэффициента сжимаемости составляет 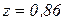 .
.
Газовые смеси
1. Газовая смесь имеет следующий массовый состав:
· метан  ;
;
· азот 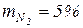 ;
;
· углекислый газ  ;
;
· этилен 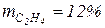 ;
;
· водород 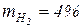 ;
;
· этан 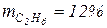 .
.
Определить молярную массу, газовую постоянную и плотность смеси, а также молярные концентрации и парциальные давления компонентов смеси, если давление смеси равно 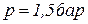 , а температура –
, а температура – 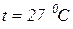 .
.
2. При давлении 820 мм рт. ст. и температуре 37 0С плотность смеси кислорода О2 и углекислого газа СО2 составляет 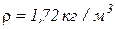 . Определить массовые и молярные концентрации компонентов смеси, а также газовую постоянную смеси.
. Определить массовые и молярные концентрации компонентов смеси, а также газовую постоянную смеси.
3. В камеру предварительного смешения камеры сгорания ГТД подается в секунду 1 кг природного газа и 16 кг воздуха. Температура воздуха перед смешением равна 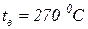 , температура природного газа
, температура природного газа 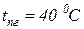 . Определить коммерческий и объемный расход газовоздушной смеси на входе в камеру сгорания, если давление в камере смешения составляет
. Определить коммерческий и объемный расход газовоздушной смеси на входе в камеру сгорания, если давление в камере смешения составляет 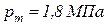 . Определить также температуру
. Определить также температуру 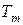 и изобарную теплоемкость смеси
и изобарную теплоемкость смеси 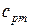 , если молярная масса природного газа равна
, если молярная масса природного газа равна 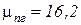 (
(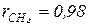 ), а его теплоемкость имеет значение cpm(пг) = 2,33 кДж/(кг·К).
), а его теплоемкость имеет значение cpm(пг) = 2,33 кДж/(кг·К).
Таблица 1
Удельные изобарные теплоемкости идеальных газов cpm, кДж/(кг·К)
| Газ | Температура, К | |||||
| Азот N2 Аммиак NH3 Водород H2 Водяной пар H2О Воздух Кислород O2 Окись углерода CO Углекислый газ CO2 Метан CH4 Этан C2H6 Пропан C3H8 Бутан н - C4H10 Пентан н - C5H12 | 1,042 - 13,98 1,856 1,006 0,915 1,043 0,800 2,143 1,588 1,460 1,478 1,468 | 1,041 2,158 14,31 1,862 1,007 0,920 1,043 0,851 2,240 1,775 1,680 1,686 1,675 | 1,042 2,207 14,43 1,870 1,009 0,929 1,045 0,900 2,379 1,978 1,910 - - | 1,045 2,287 14,48 1,877 1,014 0,942 1,049 0,942 2,535 2,188 2,130 2,132 2,120 | 1,050 2,375 14,50 1,888 1,021 0,956 1,055 0,981 2,704 2,396 2,370 - - | 1,056 2,467 14,52 1,900 1,030 0,972 1,065 1,020 2,884 2,597 2,580 2,546 2,529 |
4. Аэростат заполнен смесью, в которой по массе 40 % водорода и 60 % азота. Объем аэростата равен 6000 м3. Определить подъемную силу аэростата, если температура газовой смеси равна -3 0С, а температура и давление воздуха равны соответственно -23 0С, 400 мм рт. ст. Масса оболочки аэростата составляет 1,2 т.
Первое начало термодинамики
1. При испытании двигателей для определения мощности используется тормоз. При этом работа расходуется на преодоление сил трения и превращается в теплоту, 20 % которой рассеивается в пространстве, а 80 % отводится охлаждаемой тормоз водой.
Какой часовой расход охлаждающей воды, подводимой к тормозу, обеспечит его охлаждение, если крутящий момент на валу равен 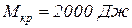 , частота оборотов вала двигателя составляет
, частота оборотов вала двигателя составляет 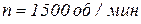 , а допустимое повышение температуры воды –
, а допустимое повышение температуры воды – 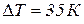 . Теплоемкость воды принять равной
. Теплоемкость воды принять равной 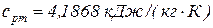 . (Мощность двигателя
. (Мощность двигателя 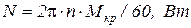 ).
).
2. Определить КПД двигателя мощностью 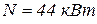 при расходе топлива
при расходе топлива  . Низшую теплоту сгорания топлива принять равной
. Низшую теплоту сгорания топлива принять равной
Qнр = 40 МДж/кг.
3. Газ переводится из состояния 1 в состояние 2 в первом случае по пути
1-а-2, а во втором по пути 1-б-2 (рис. 1). Известно, что давление в точках 1 и 2 равны соответственно 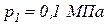 ,
, 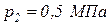 , а изменение объема
, а изменение объема 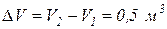 .
.
Определить, будет ли отличаться подведенное и отведенное количество теплоты, и если да, то насколько.
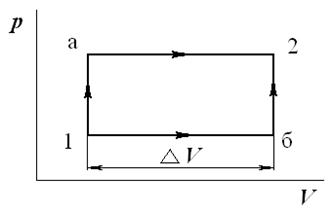
Рис. 1
4. В канале произвольной формы течет природный газ, массовый расход которого составляет  (рис. 2). На входе в канал удельная энтальпия газа, его скорость и высота входного сечения равны соответственно:
(рис. 2). На входе в канал удельная энтальпия газа, его скорость и высота входного сечения равны соответственно: 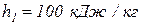 ,
, 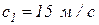 ,
, 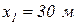 , а на выходе из канала эти характеристики потока имеют следующие значения:
, а на выходе из канала эти характеристики потока имеют следующие значения:  ,
, 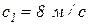 ,
, 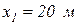 . Протекая в канале, газ отдает в окружающую среду 20 кДж/с теплоты. В канале установлена турбина. Определить, какую работу совершил бы природный газ
. Протекая в канале, газ отдает в окружающую среду 20 кДж/с теплоты. В канале установлена турбина. Определить, какую работу совершил бы природный газ  в случае обратимого процесса.
в случае обратимого процесса.

Рис. 2
Процессы
1. 1 кг метана политропно расширяется от p1 = 0,2 МПа до p2 = 0,1 МПа, причем объем его увеличился в 4 раза; начальная температура метана равна
20 0С. Определить показатель политропы, начальный и конечный объем, конечную температуру, термодинамическую и потенциальную работу. Изобарная теплоемкость равна 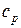 = 2,24 кДж/(кг·К). Изобразить процесс в координатах
= 2,24 кДж/(кг·К). Изобразить процесс в координатах 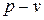 и
и 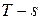 .
.
2. 5 кг метана сжимается политропно с показателем n = 2 от p1 = 0,1 МПа до p2 = 0,6 МПа. Начальная температура метана равна t1 = 15 0С. Определить работу и конечные параметры метана. Изобарная теплоемкость равна
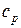 = 2,24 кДж/(кг·К). Изобразить процесс в координатах
= 2,24 кДж/(кг·К). Изобразить процесс в координатах 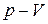 и
и 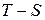 .
.
3. При политропном сжатии 1 кг воздуха до объема v2 = 0,1 v1 температура возросла с 10 0С до 90 0С; начальное давление воздуха равно 0,08 МПа. Определить конечные параметры газа, показатель политропы, термодинамическую и потенциальную работу, работу и количество теплоты. Изобарная теплоемкость равна ср = 1,005 кДж/(кг·К). Изобразить процесс в координатах 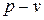 и
и 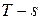 .
.
4. В цилиндре дизеля воздух с начальными параметрами: давление –
0,1 МПа и температура – 20 0С сжимается в процессе с показателем политропы n =1,36. Сжатие идет до достижения воздухом температуры 700 0С. Определить конечное давление, степень сжатия v1/v2, термодинамическую и потенциальную работу. Изобразить процесс в координатах 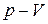 и
и 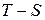 .
.
5. Воздух расширяется политропически, совершая термодинамическую работу, равную 270 кДж. Определить показатель политропы, если от воздуха отводится 92 кДж теплоты. Изобарная теплоемкость воздуха равна
cр = 1,005 кДж/(кг×К). Изобразить процесс в координатах 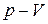 .
.
6. 0,8 м3 метана, имеющего температуру 20 0С и давление 0,7 МПа, адиабатно расширяется до трехкратного объема. Определить конечные параметры метана, термодинамическую работу, количество теплоты, изменение внутренней энергии и энтальпии. Изобарная теплоемкость равна cр = 2,25 кДж/(кг×К). Изобразить процесс в координатах 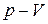 и
и 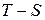 .
.
7. К 10 кг метана в изохорном процессе подведено 1885 кДж теплоты, а затем в изобарном процессе объем метана уменьшается в 2,5 раза. Начальная температура метана равна 17 0С, а давление – 0,8 МПа. Определить конечные параметры метана, работу, количество теплоты, изменение внутренней энергии. Изобарная теплоемкость метана принять равной
cр = 2,25 кДж/(кг×К). Изобразить процесс в координатах 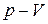 и
и 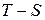 .
.
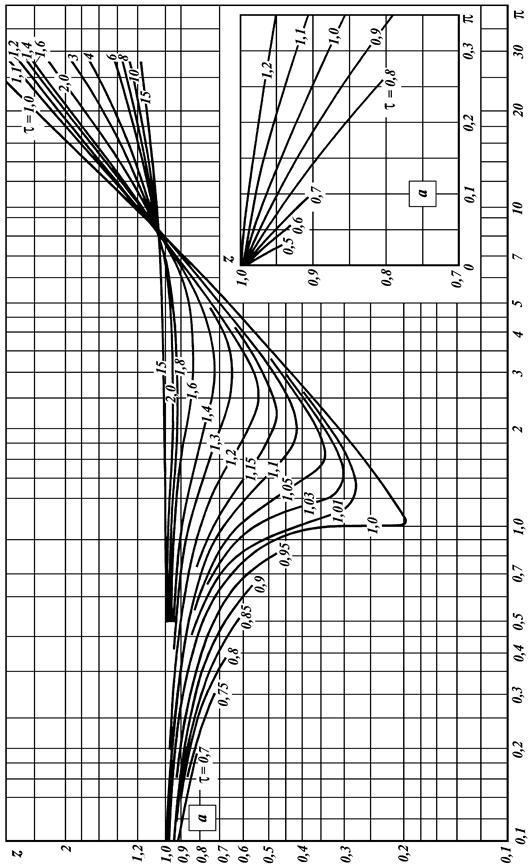
ПРИЛОЖЕНИЕ
Таблица П 1
Характеристики компонентов, входящих в состав природных газов
| Газ | Хими-ческая формула | Молярная масса 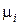 , кг/кмоль , кг/кмоль
| Крити-ческая температура Tкр, К | Крити-ческое давление pкр, МПа | Температура кипения при p = pc, Tкп, К | Фактор 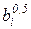
|
| Метан | CH4 | 16,043 | 190,555 | 4,5988 | 111,65 | 0,0436 |
| Этан | C2H6 | 30,070 | 305,83 | 4,880 | 184,55 | 0,0894 |
| Пропан | C3H8 | 44,097 | 369,82 | 4,250 | 231,05 | 0,1288 |
| н -Бутан | н -C4H10 | 58,123 | 425,14 | 3,784 | 272,67 | 0,1783 |
| и -Бутан | и - C4H10 | 58,123 | 408,13 | 3,648 | 261,42 | 0,1703 |
| н -Пентан | н -C5H12 | 72,150 | 469,69 | 3,364 | 309,19 | 0,2345 |
| и -Пентан | и - C5H12 | 72,150 | 460,39 | 3,381 | 301,02 | 0,2168 |
| н -Гексан | н -C6H14 | 86,177 | 506,4 | 3,030 | 341,89 | 0,2846 |
| н -Гептан | н -C7H16 | 100,204 | 539,2 | 2,740 | 371,58 | 0,3521 |
| н -Октан | н -C8H18 | 114,231 | 568,4 | 2,490 | 398,83 | 0,4278 |
| Ацетилен | C2H2 | 26,038 | 308,33 | 6,139 | 189,15 | 0,0837 |
| Этилен | C2H4 | 28,054 | 282,35 | 5,042 | 169,44 | 0,0775 |
| Пропилен | C3H6 | 42,081 | 364,85 | 4,601 | 225,45 | 0,1225 |
| Бензол | C6H6 | 78,114 | 562,16 | 4,898 | 353,25 | 0,2530 |
| Толуол | C7H8 | 92,141 | 591,80 | 4,106 | 383,78 | 0,3286 |
| Водород | H2 | 2,0159 | 33,2 | 1,297 | 20,35 | -0,0051 |
| Водяной пар | H2O | 18,0153 | 647,14 | 22,064 | 373,15 | 0,2191 |
| Аммиак | H3N | 17,0306 | 405,5 | 11,350 | 239,75 | 0,1049 |
| Метанол | CH4O | 34,042 | 512,64 | 8,092 | 337,85 | 0,3286 |
| Сероводород | H2S | 34,082 | 373,2 | 8,940 | 212,85 | 0,1000 |
| Метилмер-каптан | CH4S | 48,109 | 470,0 | 7,230 | 279,10 | 0,1483 |
| Диоксид серы | SO2 | 64,065 | 430,8 | 7,884 | 263,15 | 0,1414 |
| Гелий | He | 4,0026 | 5,19 | 0,227 | 4,21 | |
| Неон | Ne | 20,1797 | 44,40 | 2,760 | 27,09 | |
| Аргон | Ar | 39,948 | 150,65 | 4,866 | 87,29 | 0,0265 |
| Монооксид углерода | CO | 28,010 | 132,85 | 3,494 | 81,65 | 0,0200 |
| Азот | N2 | 28,135 | 126,2 | 3,390 | 77,35 | 0,0173 |
| Воздух | - | 28,9626 | - | - | - | - |
| Кислород | O2 | 31,9988 | 154,58 | 5,043 | 90,19 | 0,0265 |
| Диоксид углерода | CO2 | 44,010 | 304,20 | 7,386 | 194,65 | 0,0728 |
 |
Date: 2015-05-04; view: 2568; Нарушение авторских прав