
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коваленттік байланыстың қасиеттері
|
|
Коваленттік байланысқа тән қасиеттер — оның ұзындығы, энергиясы, қанығуы және бағытталуы.
Байланыс ұзындығы — бұл ядролардың ара қашықтығы. Байланыс ұзындығы неғұрлым қысқа болса, химиялық байланыс соншалықты берігірек болады. Алайда байланыстың беріктігінің өлшемі — байланыс энергиясы болады.
Байланыс энергиясы байланысты үзуге кажет энергияның шамасымен анықталады. Әдетте ол 1 моль затқа шаққан кило-джоулмен өлшенеді. Тәжірибе мәліметтері бойынша Н2, Сl2 және N2 молекула байланыстарының ұзындығы 0,074, 0,198, 0,109 нм (нанометрге) сай келеді, ал байланыс энергиясы 436, 242, 946 кДж/молые тең. Байланыстың еселігі артқан сайын байланыс энергиясы жоғарылайды, ал оның ұзындығы қысқарады.
Қанығу дегеніміз бұл атомның коваленттік байланыстардың шекті санын түзу қабілеті. Мәселен, сутегі атомы (бір байланыспаған электрон) бір байланыс, көміртегі атомы (қозған күйде төрт жұпталмаған электрон)—төрттен аспайтын байланыс түзеді. Байланыстардың қанығуына сай молекулалардың белгілі құрамы болады; Н2, СН4, HC1 және т. с. с. Бірақ қаныққан коваленттік байланыстар донорлы-акцепторлы механизмі бойын-ша күрделірек молекулалардың түзілуі мүмкін.
Коваленттік байланыстың бағытталуы молекулалардың кеңістіктері

құрылымына, яғни олардың геометриясына (пішініне) себепші болады. Мұны HC1, Н2О және NH3 молекулаларының түзілуін мысалға ала отырып қарастырамыз.
Қоваленттік байланыс әрекеттесуші атомдардың электрон орбитальдарының максималь қаптасатын бағытында пайда болатындығы белгілі. HC1 молекуласы түзілгенде сутегі атомынын, s-орбиталы хлор атомының р-орбиталымен қаптасады. Мұндай типті молекуланың гантель тәрізді пішіні болады (3.2, б-сурет).
Оттегі атомының сыртқы деңгейінде екі жұптаспаған электрон бар. Олардың орбитальдары өзара перпендикуляр, яғни өзара біріне-бірі 90° бұрышпен орналасады. Су молекуласы түзілгенде әрбір р-электронының орбиталі сутегі атомының ls-электронының орбиталімен координат осінің сызығының бойында жиірек қойылған нүктелермен белгіленген жерінде каптасады (3.3-сурет). Бұл жағдайда химиялық байланыстар 90° бұрышпен бағытталған болу керек. Тәжірибе жүзінде су молекуласындағы байланыстар <Н—О—Н—104,5° тең екендігі анықталған (бұл алшақтық осы параграфтың соңында түсіндірілген).
Сонымен, оттегі атомы өзінің екі жұптаспаған (валенттік) р-электрондары арқылы сутегімен бұрышты пішіні бар су молекуласын түзеді. Мұндай пішінді молекулаларды сутегімен оттегінің аналогтары — күкірт, селен, теллур түзетіндігі айғақ.
NH3 молекуласын түзуге электрон орбиталдары өзара перпендикуляр азот атомының үш жұптаспаған р-электроны мен үш сутегі атомының 1s электрондары қатысады. Байланыстар р-орбиталдарының үш осьінің бойында орналасады (3.4-сурет). Молекуланың пішіні дұрыс пирамида тәрізді, үшбұрыштың бұрыштарында сутегі атомдары, пирамиданың төбесінде азот атомы орналасқан. Байланыстардың арасындағы бұрыш <Н—N—Н = 107,3°. Осындай пішіні болатын молекулаларды (бірақ бұрышының мәні басқарақ) сутегімен азотқа ұқсас — фосфор, мышьяк, сурьма да береді.
Көп валентті атоімдар арқылы түзілетін коваленттік байланыстардың барлық уақытта кеңістікте бағытталуы болады. Байланыс арасындағы бұрышты валентті бұрыш деп атайды.
Көбінесе коваленттік байланысты түзуге қатысатын электрондар әртүрлі күйде, мәселен біреуі s-, екіншісі р-орбиталдарында болады. Мұндай жағдайда молекуладағы байланыстар тұрақтылығы бойынша бірдей болмауға тиіс сияқты. Алайда, олардың бірдей екендігін тәжірибе көрсетті. Бұл құбылыс Л. Полинг енгізген атом орбиталдарының гибридтену туралы түсінік бойынша түсіндіріледі.
Валентті орбитальдардың гибридтенуін бериллий хлориді ВеСl2, бор хлориді ВС13 және метан СН4 молекуласының тузілу мысалында қарастыра-мыз.
Бериллий атомының козған күйге ауысуы жұптасқан электрондардың яғни қос электронды бұлттың (2s2) бір электронды бұлтқа бөлінуі арқылы жүреді. Мұны келесі схемамен бейнелеуге болады:
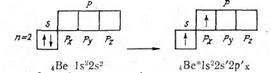
2s электронды 2p-орбиталына өткізу, яғни атомиың қозған күйге ауы-суы энергия жұмсауды қажет етеді. Ол реакция кезінде екі байланыстың түзілуінің нәтижесінде артығымен компенсацияланады. Қозған күйдегі бериллий хлордың екі атомын қосып алады.

Екі Be—C1 байланысының беріктігі бірдей және 180° бұрышпен орналасқан.
Байланыстардың беріктігінің бірдейлігі валентті (сыртқы) орбиталдардың гибридтенуімен, яғни одардың араласуымен және пішіні мен энергиясы бойынша бірдей болуымен түсіндіріледі. Бұл жағдайда атомның электрондық орбиталдарының алғащқы пішіні мен энергиясы өзара өзгеріп бірдей пішіні мен энергиясы болатын электрондық орбиталдар түзеді. Гибридтенген орбитал ассиметриялы, ядроның бір жағына қарай күшті созылған (3.5-сурет).
Гибридтенген - орбиталь электрондарының қатысуымен түзілген химиялык байланыс гибридтенбеген (таза) s- және р-орбиталдары- 
ның электрондарының қатысуымен пайда болған байланысқа қарағанда мықтылау келеді, себебі гибридтену кезінде қаптасу молырақ болады. Берілген атомының байланыстарын түзуге әр типті (біздің мысалда s -және р-электрондар) электрондар қатысқанда барып гибридтену іске асады. Мұнда гибридтенген орбиталдардың саны алғашқылардың санына тең болады
 .
.
Сонымен, ВеСl2 молекуласындағы химиялық байланысты түзуге орталық атомның, яғни бериллийдің бір s- және бір р-электроны қатысады. Мұнда орбиталдың sp-гибридтенуі болады (эс-пе-гибридтену деп оқылады) (3.6-сурет). Екі гибридтенген орбиталдар өзара 180° бұрышпен орналасады, яғни ВеСl2 молекуласында пішіні сызықтық — атомның үшеуі де бір сызық-тық бойында орналасқан (3.7-сурет).

Бор хлориді ВС13 молекуласында орталық атомның орбиталының 5р2-гибридтенуі болады (эс-пе-екі-гибридтену деп оқылады).
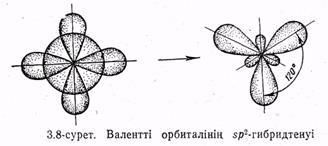
Бор атомынан (электрондық құрылымы Is22s22p\ қозғалған күйде Is22s'2p2) гибридтенуге бір s және екі р-электрондарының орбиталдары қатысады. Бұл өзара 120° бұрышпен орналасқан үш гибридтенген орбиталдың түзілуіне әкеледі (3.8-сурет). ВС13молекуласының пішіні центрінде В атомы орналасқан жазық тең қабырғалы үшбұрыш түрінде болады. Гибридтенген орбиталдардың осьтерінің арасындағы бұрыш 120° тең, атомның төртеуі де бір жазықтықта жатыр (3.9-сурет).
Метан молекуласы түзілгенде көміртегі атомы қозған күйге ауысады, осының нәтижесінде жұптасқан 25-электрондар ажырайды, яғни қос электронды бұлт бір электронды бұлтқа ыдырайды:
- 

Схемадан, көміртегі атомының негізгі күйінде 2 жұптаспаған электронның (екі валентті), қозған күйде (жұлдызшамен көрсетілген) төрт электроннық (төрт валентті) бары көрініп тұр және ол төрт сутегі атомын қосып ала алады:

Метан молекуласы түзілерде көміртегі атомының бір s- және үш р-электронының орбиталы гибридтенуге ұшырады да төрт бірдей гибридтенген орбиталдар алынды (3.10-сурет). Мұндай гибридтенуді 5р3-гибридтену деп атайды (эс—пе—үш—гибридтену деп оқылады). Гибридті орбитальдардың осьтерінің арасындағы валенттік бұрыш 109°28' болады.
Су молекуласы мен аммиактағы байланыстардьщ валенттік бұрыштары тетраэдрдағыдан кішірек болуы орбитальдардың гибридтенуімен түсіндіріледі (3.3 пен 3.4-суретті қара). Метанның түзілуі кезіндегідей су мен аммиак молекуласы түзілгенде оттегі мен азот атомдарының атомдық орбиталдарының sp3-гибридтенуі болады. Бірақ көміртегі атомындағы төрт sp3-opбиталдар байланыстырушы электрон жұптарына толған (3.11-суретті қара), ал азот атомында төртеудің бір sр3-орбиталы бір байланыстырмайтын электрон жұбымен толған (3.4-сурет), ал оттегі атомында олармен екі sр3-орбиталі

толған (3.3-суретті қара). Сонымен, бұрыштың тетраэдрліктен өзгеруіне (109°28'),5р3-гибридтенген орбиталдардан орын алатын бөлінбеген (байланыстырмайтын) электрон жұптарының тебуі әсер етеді: азот атомында ол біреу (бұрыш 107,3°),оттегі атомында ол екеу (бұрыш 104,5°).
Валентті орбиталдардың гибридтенуі туралы түсінік органикалық химияда кең қолданылады (III бөлімді қара).

Date: 2015-11-13; view: 7016; Нарушение авторских прав