
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сурет. Хлор СІ2(а) және хлорсутек НС!(б) молекулаларындағы химиялық байланыстардың түзілу схемасы
|
|
Егер атомдар арасында бір коваленттік байланыс пайда болса (ортақ бір электрондық жұп), онда оны дара; егер одан көп болса, онда еселі: қосарланған (ортақ екі электрондық жұп), үш еселенген (ортақ үш электрондық жұп) дейді.
Дара байланыс жалғыз (штрихпен) сызықшамен, қос — екі, үш еселенген — үш сызықшамен бейнеленеді. Атомның арасындағы сызықша олардың электрондық жұптарының ортақ екендігін осының нәтижесінде химиялық байланыстың түзілгенін көрсетеді.
Осындай сызықшалар арқылы молекулалардың қүрылым формулаларын өрнектейді (§ 3.8. қара).
Сонымен, хлор молекуласындағы әрбір хлор атомының аяқталған деңгейінде 8 электрон (s2ps) бар, олардың екеуі (электрондық жұп) екі атомға бірдей мөлшерде қатысты болады. Хлор молекуласы түзілгенде электрондық бұлттардың қаптасуы 3.2-суретте көрсетілген.
Оттегі молекуласындағы байланысты басқаша өрнектейді. Оттегінің парамагнитті зат екендігі (магнит өрісіне тартылады), эксперимент жүзінде дәлелденген. Оның молекулаларында екі жұптаспаған электрон бар. Бұл молекуланың құрылымып былай бейнелеуге болады:

Оттегі молекуласынэлектрондық құрылымын бейнелеу туралы бір жақты шешім әлі табылған жоқ*. Алайда, оны былайша бейнелеуге болмайды:
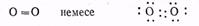
Азот молекуласының атомында үш ортақ электрондық жұп бар.

Азот молекуласыоттегі немесе хлор молекуласына қарағанда берігірек екендігі айқын, бұл азоттың химиялық реакцияларда инерттілеу болуына себепші.
Электрондық жұптар арқылы пайда болатын химиялық байланысты атомдық немесе коваленттік байланыс деп атайды. Бұл екі электронды және екі центрлі (екі ядроны ұстап турады) байланыс. Коваленттік байланысты қосылысты гомеполюсті немесе атомдық қосылысдеп атайды.
Коваленттік байланыстың екі түрі бар: полюссіз және полюсті.
Полюссіз коваленттік байлпныс болғанда ортақ электрондық жұптары арқылы түзілген электрондық бұлт немесе байланыстың электрондық бұлты екі атомның ядросына сай кеңістікте симметрия болып таралады. Бұған бір элементтің атомдарынан құралған екі атомды молекулалар мысал болады: Н2, Сl2, О2, N2, Ғ2 және т. б. Олардың электрондық жұбы екі атомға бірдей қа-тысты болады.
Полюсті коваленттік байланыс болғанда байланыстың электрон бұлты электртерістігі көптеу атомға, яғни электрон бұлты салыстырмалы электртерістігі үлкен атомға қарай ығысады. Бұған ұшқыш бейорганикалық қосылыстардың молекулалары мысал болады: HC1, Н2О, H2S, NH3 және т. б.
HC1 молекуласының түзілуін мына схема бойынша көрсетуге болады:
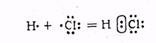
Электрон жұбы хлор атомына карай ығысқан, себебі хлор атомының салыстырмалы электртерістігі (2,83) сутегі атомыныкінен үлкен (2,1).
Коваленттік байланыс тек қана бір электронды бұлттардың қаптасуымен ғана түзіліп қоймайды — бұл ковалентті байланыстың түзілуінің алмасу механизмі. Коваленттік байланыстың түзілуінің басқа механизмі донорлы-акцепторлы механизмі болуы мүмкін. Бұл жағдайда химиялық байланыс бір атомның қос электронды бұлты мен басқа атомның бос орбиталы арқылы түзіледі. Мысал ретінде аммоний NH  ионының түзілу механизмін қарастырамыз. Аммиак молекуласындағы азот атомында
ионының түзілу механизмін қарастырамыз. Аммиак молекуласындағы азот атомында
Н
бөлінбеген электрон жұбы (қос электронды бүлт) бар: H:  :.
:.
Н
Сутек ионында Is—орбитал бос (толмаған), оны ڤН+ деп белгілеуге болады. Аммоний ионы түзілгенде азоттың қос электронды бұлты азот пен сутек атомдарының екеуіне де ортақ болады, яғни ол молекулалық электрон бұлтына айналады. Демек, төртінші коваленттік байланыс пайда болады. Аммоний ионының түзілу процесін мына схема бойынша көрсетуге болады:

Сутегі ионының заряды ортақ (ол барлық атомдар арасында таралған), яғни делокалданған, ал азоттың қос электрон бұлты (бөлінбеген электрон жұбы) сутегіге де ортақ болады. Схемаларда ячейканы ڤ белгілеу квбінесе алынып тасталады.
Бөлінбеген электрон жұбын беретін атом — донор, ал оны қабылдайтын (яғни, бос орбиталь беретін) атом-акцептор деп аталады.
Бір атомның қос электрон бұлты (донор) жэне басқа атомының бос орбиталы (акцептор) арқылы коваленттік байланыстың түзілу механизмін донорлы-акцепторлы деп атайды. Мұндай жолмен түзілген коваленттік байланысты көбінесе донорлы-акцепторлық немесе координациялық байланыс деп атайды.
Алайда бұл байланыстың ерекше түрі емес, ол коваленттік байланыстың түзілуінің басқаша механизмі (тәсілі). Аммоний ионындағы төртінші N—Н байланыс өзінің қасиеттері бойынша басқаларынан өзгешелігі жоқ.
Date: 2015-11-13; view: 2798; Нарушение авторских прав