
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Полюсті және полюссіз молекулалар
|
|
Бір жақты полюстену молекуладағы электрон тығыздығының біркелкі таралмауына әкеледі. Мысалы, НСІ молекуласында хлор ядросындағы электрон тығыздығы сутегі ядросына қарағанда жоғарылау болады. Молекуладағы оң және теріс зарядтардың электр центрлері бір нүктеде түйіспейді, өзара біраз қашықтықта жатады (3.12-сурет). Жалпы нейтралданған молекула хлор атомында — q заряды, ал сутегі атомында +q заряды бар электр диполы болып саналады. Мұндай байланыстар мен молекулалар полюсті деп аталады. Молекуладағы атомдардың заряды q тиімді заряд деп аталады (НСІ молекуласындағы электронның абсолюттік заряды qСl = −0,18, qН = +0,18, байланыстың иондық дәрежесі 18%).
Байланыс пен молекуланың полюстігінің өлшемі — диполдың электр моменті μ (мю) 
Q·l
көбейтіндісімен анықталады. Мұндағы q— тиімді заряд; l — диполь ұзындығы.
СИ системасында диполдың электр моментінің бірлігі 3,33·10−30 Кл·м (кулон-метр) мәнімен өрнектеледі.
Диполдың электр моменті — векторлық шама. Оның бағытын шартты түрде оң зарядтан теріс зарядқа — байланыстырушы электрон бұлтының ығысқан бағытына сай етіп алады.
Әртүрлі байланыстар мен заттардың көпшілігі үшін диполдың электр моменті тәжірибе жүзінде анықталған (олардың мәндері 0-ден 36,6·10−30 Кл·м аралығында болады).
Молекуланьщ полюстігін байланыстың полюстігінен айыра білу керек. Бұл түсініктер АВ типті екі атомды молекулалар үшін бірдей болады, бұл жоғарыда НСІ молекуласының мысалында көрсетілген. Мұндай молекулаларда элементтердің электртерістігінің айырымы қаншалықты үлкен болса, диполдың электр моменті соншалықты жоғары болады.
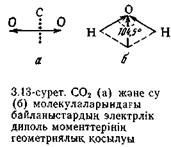
Көп атомды молекулалардағы атомдардың арасындағы байланыс полюсті болуы мүмкін, ал молекулалардың өздері кеңістіктегі құрылысына қарай полюсті немесе полюссіз болуы мүмкін. Мұндай молекулалардағы диполдың электр моменті полюсті байланыстардың санымен және олардың бағытталуымен анықталады. Ол жеке байланыстардың диполь моментінің векторлық қосындысына тең. Мәселен, С = О байланысындағы диполдың электр моменті 9·10−30 Кл м·ге, ал СО2 молекуласында 0-ге тең. Себебі: СО2-нің сызықтық молекуласындағы байланыстардың векторы центрден радикал бағытталған, сондықтан жиынтық момент μ 0-ге (3.13, а-суретті қара) тең. Бұрышты молекулада Н20 байланыстар 104,5° бұрышпен орналасқан және екі байланыстың вектор қосындысы μ параллелограмның диагоналы бойынша өрнектеледі (векторларды қосу параллелограм ережесі бойынша жүргізіледі, 3.13, б-сурет). Су ушін μ=6,1·10-3 Кл м. Егер әртүрлі диполдардың электр моментінің геометриялық жиынды векторы нөлге тең болмаса, онда молекула полюсті болады.
Өз кезегінде μ мәні мен бағыты бойынша молекуланың геометриялық құрылысы туралы біршама дәрежеде болжауға болады, Мысалы, SО2 моле-куласы үшін μ=5,4+10-30 Кл м. Демек, су молекуласы тәрізді, оның бұрыш-тық құрылысы болуға тиіс.
Полюссіз коваленттік байланыстан тұратын молекулаларды полюссіз немесе гомеополюсті деп атайды. Мұндай молекулалардағы байланыстырушы электрон бұлты екі атом ядросы арасына симметриялы болып бөлінеді және оған ядролар бірдей әсер етеді. Оларға бір элементтің атомынан тұратын жай заттардың молекулалары мысал болады. Н2, Ғ2, Сl2, О2 және т. б. Мұндай молекулалардағы диполдың электр моменті нөлге тең. Симметрия болып құралған күрделі заттардың молекулаларындағы атомдар арасындағы байланыс полюсті болғанмен олардың полюссіз екендігі айтылған болатын. Полюссіз коваленттік байланысы бар заттар көп емес.
Сыртқы электр өрісінің әсерінен молекулалардың (кейбір байланыстардың) полюстену қабілетін полюстенгіштік деп атайды.
Бұл полюсті молекула жақындағанда пайда болатын өрістің әсерінен де тууы мүмкін. Сондықтан полюстіліктің химиялык реакцияларда үлкен маңызы бар.
Бар уақытта да молекуланың полюстігі мен оның диполының электр моментін есепке алу маңызды. Заттардың реакцияласу кабілеті соларға байланысты. Молекула диполының электр моменті қаншалықты үлкен болса, заттың реакциялық қабілеті соншалықты жоғары болады. Заттың ерігіштігі де диполдың электр моментімен байланысты. Сұйықтықтардың полюсті молекулалары олардағы еріген электролиттердің электролиттік диссоциациялануына жағдай жасайды.
Date: 2015-11-13; view: 2668; Нарушение авторских прав