
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Бірдей жағдайда (температурада және қысымда) әртүрлі газдардың тең көлемдеріндегі молекула сандары бірдей болады
|
|
Авогадро заңынан маңызды салдар шығады: әртүрлі газдардың 1 молі бірдей жағдайда бірдей көлем алады. Бұл көлемді 1 л газдың массасы белгілі болса оңай есептеуге болады. Қалыпты жағдайда, яғни температура 273 К (0°С) және қысым 101 325 Па, 1 л сутегінін, массасы 0,09 г тең, ал оның молярлық массасы 1,008·2= 2,016 г/мольге тең. Онда 1 моль сутегінің алатын көлемі:

Сондай жағдайда 1 л оттегінің массасы—1,429 г, молярлық массасы —32 г/моль. Онда көлем

Демек, қалыпты жағдайда кез-келген газдың 1 молі 22,4 литрге тең көлем алады. Бұл көлем газдың молярлық көлемі деп аталады. Газдың молярлық көлемі — бұл зат көлемінің сол заттың шамасына қатынасы:
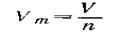
Мұндағы, Vm— газдардың молярлық көлемі (өлшемі м3/моль немесе л/моль), V — жүйедегі заттың көлемі; п —жүйедегі заттың мөлшері. Жазудың мысалы: Vm газдікі (қ. ж.)≈22,4 л/моль.
Авогадро ілімі 1860 жылы Карслруэде өткен химиктердің халықаралық съезінде бүкіл жұртшылық қабылдады. Съезд атом-молекулалық ілімнің дамуына күшті әсер етті. Әсіресе ол Д. И. Менделеевтің химиялық элементтердің периодтық заңын ашқаннан кейін қауырт дамыды.
Авогадро заңы бойынша газ күйіндегі заттардың массаларын анықтайды. Егер газдың молекуласының массасы көп болса, онда оның бірдей көлемінің массасы үлкен болады. Бірдей жағдайда газдардың бірдей көлемінде молекулалар саны бірдей болады, демек моль саны да бірдей болады. Газдардың бірдей көлемдерінің массаларының қатынасы олардың молярлық массаларының қатынасына тең:
m1:m2=M1:M2
мұндағы m1 — бірінші газдың белгілі көлемінің массасы, m2 — екінші газдың сондай көлемінің массасы, М1 мен М2— бірінші және екінші газдардың молярлық массалары.
Бір газдың белгілі көлемінің массасының басқа газдың сондай көлемінің массасына (сондай жағдайда алынған) қатынасы бірінші газдың екінші газ бойынша тығыздығы деп аталады. (D әрпімен белгіленеді):
 бұдан М1=М2D. (1.7)
бұдан М1=М2D. (1.7)
Әдетте газдың тығыздығын ең жеңіл газ сутегі бойынша (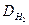 белгіленеді) анықтайды. Сутегінің молярлық массасы, 2,016 г/моль немесе шамамен 2 г/мольге тең.
белгіленеді) анықтайды. Сутегінің молярлық массасы, 2,016 г/моль немесе шамамен 2 г/мольге тең.
Сондықтан, М = 2 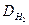 болады. (1.8)
болады. (1.8)
Date: 2015-11-13; view: 2386; Нарушение авторских прав