
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства оксидов
|
|
Физические свойства оксидов разнообразны. Одни из них – газообразные вещества (SO2, SO3, CO2, NO), другие – жидкости (N2O4, Mn2O7), третьи – твёрдые (CaO, SiО2, P2O5).
Химические свойства оксидов определяются их взаимодействием с водой и другими оксидами, кислотами, щелочами.
О с н о в н ы е о к с и д ы
а) В з а и м о д е й с т в и е с в о д о й.
Оснόвные оксиды Li2O, Na2O, K2O, CaO, BaO реагируют с водой согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | ВОДА | = | ОСНОВАНИЕ |
При написании уравнений таких реакций следует помнить, что степень окисления металла в образующемся основании равна его степени окисления в исходном оксиде.
Примеры:
 + H2O = 2
+ H2O = 2 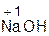 ;
;  + H2O =
+ H2O =  .
.
оксид вода гидроксид оксид вода гидроксид
натрия натрия бария бария
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
| ОСНОВНЫЙ ОКСИД | + | кислота | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли валентность металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Примеры:
 + 2
+ 2  =
=  + H2O;
+ H2O;  +
+  =
=  + H2O;
+ H2O;
оксид хлорово- хлорид вода оксид серная сульфат вода
кальция дородная кальция натрия кислота натрия
кислота
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | КИСЛОТНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. NO3. Его заряд, как вы уже знаете, равен 1–:
 +
+  =
=  .
.
оксид оксид нитрат
кальция азота(V) кальция
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4 с с зарядом, равным 3–:
3  +
+  = 2
= 2  .
.
оксид оксид фосфат
натрия фосфора(V) натрия
К и с л о т н ы е о к с и д ы
а)В з а и м о д е й с т в и е с в о д о й
Кислотные оксиды, кроме оксида кремния SiO2, реагируют с водой согласно общей схемы:
| кислотный ОКСИД | + | ВОДА | = | КИСЛОРОДСОДЕРЖАЩАЯ КИСЛОТА |
Например:
SO3 + H2O = H2SO4; CO2 + H2O = H2CO3
оксид вода серная оксид вода угольная
серы(VI) кислота углерода(IV) кислота
P2O5 + 3H2O = 2H3PO4; N2O5 + H2O = 2HNO3;
оксид вода фосфорная оксид вода азотная
фосфора(V) кислота азота(V) кислота
Таким образом, каждому кислотному оксиду соответствует кислородсодержащая кислота. Несмотря на то, что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но её получают другими способами.
б)В з а и м о д е й с т в и е со щ ё л о ч а м и
Все кислотные оксиды реагируют с щёлочами согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ЩЁЛОЧЬ | = | СОЛЬ | + | ВОДА |
В образующейся соли степень окисления металла такая же, как и в исходной щёлочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2 CO3 (указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3, заряд которого равен 2–:
 +
+  =
=  + H2O.
+ H2O.
оксид гидроксид карбонат вода
углерода(IV) натрия натрия
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. NO3 с зарядом, равным 1–:
 +
+  =
=  + H2O.
+ H2O.
оксид гидроксид нитрат вода
азата(V) кальция кальция
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2 SO4 (указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. SO4:
 +
+  =
=  .
.
оксид оксид сульфат
серы(VI) натрия натрия
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4:
 + 3
+ 3 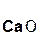 =
=  .
.
оксид оксид фосфат
фосфора(V) кальция кальция
А м ф о т е р н ы е о к с и д ы
Амфотерные оксиды обладают свойствами как оснóвных, так и кислотных оксидов, т. е. они взаимодействуют и с кислотами, и со щелочами. В обоих случаях образуется соль и вода. Например, амфотерный оксид цинка взаимодействует с соляной кислотой согласно уравнению:
ZnO + 2HCl = ZnCl2 + H2O
При взаимодействии этого оксида с расплавленной щелочью образуется цинкат – соль несуществующей «цинковой кислоты» H2ZnO2 (это – формула гидроксида цинка Zn(OH)2, записанная в виде кислоты: Zn(OH)2 = H2ZnO2). Поэтому уравнение данной реакции имеет вид:
ZnO + 2NaOH (распл)  Na2ZnO2 + H2O.
Na2ZnO2 + H2O.
Если же амфотерный оксид реагирует со щёлочью не в расплаве, а в водном растворе, то в реакции принимает участие и вода. При этом образуется комплексное соединение:
ZnO + 2NaOH + H2O = (Na2ZnO2 · 2H2O) = Na2[Zn(OH)4].
Так же взаимодействуют с кислотами и щелочами амфотерные оксиды бериллия, олова(II) и свинца(II).
Амфотерный оксид алюминия реагирует с азотной кислотой согласно уравнению:
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O.
При взаимодействии этого оксида с расплавленной щелочью могут образоваться соли несуществующих «алюминиевых кислот» H3AlO3 и HAlO2 – соответственно ортоалюминаты и метаалюминаты. Поэтому уравнения указанных реакций имеют вид:
Al2O3 + 6NaOH (распл)  2Na3AlO3 + 3H2O;
2Na3AlO3 + 3H2O;
Al2O3 + 2NaOH (распл)  2NaAlO2 + H2O;
2NaAlO2 + H2O;
При взаимодействии оксида алюминия со щёлочью в водном растворе в реакции принимает участие и вода. При этом образуются комплексные соединения:
Al2O3 + 6NaOH + 3H2O = (2Na3AlO3 · 3H2O) = 2Na3[Al(OH)6];
Al2O3 + 2NaOH + 3H2O = (2NaAlO2 · 2H2O) = 2Na[Al(OH)4].
Амфотерные оксиды взаимодействуют как с кислотными, так и с оснóвными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3; ZnO + P2O5 = Zn3(PO4)2;
Al2O3 + Na2O = 2NaAlO2; BeO + CaO = CaBeO2.
Date: 2015-11-13; view: 502; Нарушение авторских прав