
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение. 1. Массовая доля растворенного вещества показывает, какую часть массы всего раствора составляет масса растворенного вещества
|
|
1. МАССОВАЯ ДОЛЯ РАСТВОРЕННОГО ВЕЩЕСТВА показывает, какую часть массы всего раствора составляет масса растворенного вещества, Массовую долю находят как отношение массы растворенного вещества m(в-ва) к массе всего раствора m(р-ра) и выражают:
в долях единицы 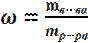
или
в процентах  , (%)
, (%)
Массовая доля в процентах ω% показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
Чтобы вычислить массовую долю К2С03, необходимо знать массу К2С03 и массу всего раствора. По условию m(К2С03) = 54,5 г.
Массу раствора можно найти, зная его плотность и объем:
m(р-ра) = р ∙ V(p-pa) = 1,09(г/см3) ∙ 500(cм3) = 545 (г);
V(p-pa) = 0,5 дм3 =500 см3
Отсюда, массовая доля карбоната калия в растворе равна
ω(К2СО3)=m(К2СО3)/m(р-ра) = 54,5/545 =0,1 (или 10%).
2. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ РАСТВОРА См показывает, какое количество растворенного вещества (в моль) содержится в 1 дм3 раствора.
Молярную концентрацию (моль/ дм3) находят по формуле
 ,
,
где n(в-ва) - количество растворенного вещества, моль;
V(p-pa) - объем раствора, дм3.
Зная массу вещества в растворе и его молярную массу (М), можно найти количество вещества (в моль):
n(в-ва) = m(в-ва)/ М(в - ва).
М(К2С03)=2·39+12+3·16 = 138 (г/моль);
n(К2С03)=m(К2С03)/ М(К2С03)=54,5(г)/138(г/моль)
n(К2С03)=0,395(моль).
Отсюда молярность раствора равна
Cм = n(К2С03)/ V(p-pa) =0,395(моль)/ 0,5(дм3)=0,79(моль/ дм3).
Или можно сказать, что мы имеем 0,79 М раствор карбоната калия.
3. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ ЭКВИВАЛЕНТА Сэк (или нормальная, или эквивалентная концентрация) показывает, сколько моль эквивалентов растворенного вещества содержится в 1 дм3 раствора. Молярную концентрацию эквивалента (моль/ дм3) находят по формуле
 .
.
Число моль эквивалентов вещества можно найти, зная его массу в растворе и эквивалентную массу Мэк.
nэк(в-ва)= m(в-ва)/ Мэк(в-ва)
Эквивалент - это условная или реальная частица соответствующая в реакциях обмена одному атому водорода (Н), а в окислительно-восстановительных реакциях - одному электрону. Один моль эквивалентов характеризуют массой
Мэк(в-ва)=fэк ∙ М(в-ва),
где М(в-ва) - молярная масса вещества (г/моль),
fэк -фактор эквивалентности, показывающий, какую часть от реальной частицы (молекулы, атома, иона и т.д.) вещества, составляет эквивалент этого вещества. Для реакций обмена:
 ,
,
где zkt -заряд катиона (функциональной группы) в формуле вещества;
nkt -число катионов (функциональных групп) в формуле вещества.
Для К2С03 заряд катиона +1, а число их равно 2, следовательно, фактор эквивалентности равен fэк(К2С03) =1/2.
Молярная масса эквивалента Мэк(К2С03) =1/2 М(К2С03)=138/2=69(г/моль эк),
число моль эквивалентов nэк(К2С03)=m(К2С03)/Мэк(К2С03)=54,5(г)/69(г/моль-эк) = 0,79(моль).
Молярная концентрация эквивалента для раствора карбоната калия равна:
Сэк = nэк(К2С03)/ V(p-ра) = 0,79(моль/дм3)/0,5(моль/дм3 ) = 1,58 (моль/ дм3).
Или можно сказать, что мы имеем 1,58 Н раствор карбоната калия.
Молярная концентрация эквивалента во столько раз больше молярной, во сколько раз Мэк(в-ва) меньше М(в-ва):
См= fэк ·Сэк.
4. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ Cm показывает, сколько моль растворенного вещества приходится на 1 кг растворителя. Моляльность находят по формуле
 , (моль/кг).
, (моль/кг).
Массу растворителя m(р-ля) можно найти как разность между массой всего раствора и массой растворенного вещества:
m(р-ля) = m(р-ра) - m(в-ва);
m(Н20) = m(p-pa) - m(K2C03) = 545 - 54,5 = 490,5(г) = 0,491 (кг);
n(К2С03) =0,395 (моль);
Отсюда моляльная концентрация раствора равна:
Cm =n(К2СОз)/m(Н20) = 0,395(моль)/0,491(кг)=0,804(моль/кгн2о).
5. ТИТР Т раствора показывает, сколько граммов растворенного вещества содержится в 1 см3 раствора. Титр можно вычислить по формуле
 , (см3).
, (см3).
Для раствора карбоната калия титр равен
T= m(K2C03) / V(p-pa) =54,5/500=0,109 (г/ см3).
6. МОЛЬНУЮ ДОЛЮ РАСТВОРЕННОГО ВЕЩЕСТВА N находят как отношение числа моль растворенного вещества к общему числу моль всех веществ в растворе:
 .
.
Для раствора K2C03: n(K2C03) =0,395 (моль)
n(Н20)= m(Н20)/M(Н20)=490,5(г)/18(г/моль)=27,25(моль)
M(Н20)=2·1·16=18(г/моль)
Мольная доля карбоната калия в растворе равна
N(К2С03)=0,395/(0,395+27,25)=0,014
Date: 2015-11-13; view: 580; Нарушение авторских прав