
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Смещение химического равновесия
|
|
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют:
1) концентрация реагирующих веществ;
2) температура;
3) давление (для газов).
Изменение одного из этих параметров приводит к нарушению равновесия: (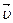 ≠
≠  ).
).
Если 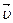 >
>  , то равновесие смещается вправо, в направлении образования.продуктов реакции, что обозначают (→). Если
, то равновесие смещается вправо, в направлении образования.продуктов реакции, что обозначают (→). Если 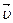 <
<  , то равновесие смещается влево (←), в направлении образования исходных веществ.
, то равновесие смещается влево (←), в направлении образования исходных веществ.
Направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместиться в том направлении, которое ослабит внешнее воздействие.
1. Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. При увеличении концентрации одного из веществ равновесие системы смещается в сторону той реакции, которая ее уменьшает.
2. Повышение температуры смещает равновесие в сторону эндотермической реакции (∆Н > 0), а понижение - в сторону экзотермической (∆Н < 0).
3. Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвует хотя бы одно газообразное вещество и число моль исходных газообразных веществ и газообразных продуктов реакции не одинаково. При уменьшении или увеличении давления равновесие смешается соответственно в сторону образования большего или меньшего числа моль газа.
Пример 3. При каких условиях равновесие реакции:
4Fe (к) + 3О2 (г) «2Fе2О3 (к), DН0r = -1644,4 кДж
будет смещаться в сторону разложения оксида?
Решение. 1. Смещение равновесия в сторону разложения оксида означает смещение его влево, т.е. увеличение скорости обратной реакции, которая является эндотермической. Прямая реакция по условию экзотермическая (DН0r < О). Такое смещении, согласно принципу Ле-Шателье, достигается повышением температуры.
2. Приведенная обратимая реакция является гетерогенной. В ней участвует одно газообразное вещество - кислород, являющееся исходным. Для смещения равновесия в направлении образования О2 () его концентрацию необходимо уменьшить,, что равнозначно понижению давления в системе.
Date: 2015-10-21; view: 826; Нарушение авторских прав