
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Скорость химической реакции
|
|
Химическая кинетика - наука о механизмах и скоростях химических реакций.
Скорость химической реакции равна изменению количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице реакционного пространства:
В зависимости от типа химической реакции (гомогенная или гетерогенная) меняется тип реакционного пространства. Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе). Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Например:
Н2(г)+Сl2(г) = 2НСl(г).
Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной. Примером гетерогенной реакции является горение угля:
С(к) + O2(г) = СO2(г).
Скорость реакции обозначается буквой 1), концентраций вещества обычно выражают в моль на литр (моль/л), а время в секундах или минутах:

где t1 и t2 - начальный и конечный моменты времени; С1 и С2 -концентрации вещества в момент времени t1 и t2.
Знак определяется направлением изменения концентрации вещества. Плюс означает увеличение концентрации, минус - ее уменьшение. Скорость реакции всегда положительна (υ > 0).
Из определения скорости реакции следует, что она имеет размерность [моль∙л-1∙с-1].
Скорость химической реакции зависит:
1) от природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) температуры;
4) присутствия катализатора.
Количественно зависимость скорости реакции от концентра-
ции реагирующих веществ выражается законом действующих масс:
скорость реакции пропорциональна произведению молярных концентраций всех реагентов, в степенях, равных стехиометриче-скому коэффициенту при соответствующем реагенте уравнения реакции. В общем виде для гомогенной реакции:
аА + вВ = dD + fF
υ = k[A]a -[В]в или v = k СаА∙Свв.
Для обозначения концентраций реагентов или продуктов реакции принято использовать букву «С» или квадратные скобки; СА, Св - концентрации вещества А и В, моль/л; [А], [В] - равновесные концентрации веществ А и В; а и в - стехиометрические коэффициенты перед веществами А и В в уравнении реакции; k - коэффициент пропорциональности, называемый константой скорости реакции, зависит от природы реагирующих веществ, температуры и наличия катализатора. Например, выражение скорости реакции:
2СО(г) + O2 (г) = 2СO2(г) имеет вид:
υ = k∙[CO]2 ∙[О2] или υ = k∙C2CO ∙ОO2.
Для гетерогенных реакций типа
аА(г) + вВ(к) = сС(к)
выражение скорости реакции имеет вид: υ = kCaA или υ = k[A]a.
Концентрации веществ, находящихся в конденсированном состоянии, постоянны и включаются в константу скорости реакции, поэтому при записи выражения v гетерогенной реакции они не учитываются. Например, выражение скорости для гетерогенной реакции:
2S (к) + 3О2(г) = 2SO3(г)
имеет вид: v = k С3O2.
Пример 1. Как изменится скорость реакции
4НС1(г) + О2(г) = 2С12(г) + 2Н2О(г),
если а) увеличить концентрацию хлороводорода в 3 раза; б) уменьшить давление в системе в 2 раза?
Решение. Скорость данной реакции, согласно закону действующих масс, описывается уравнением: υ 1 = kC4HClCO2
После увеличения концентрации НС1 в 3 раза, скорость реак-
ции будет равна: υ 2 = k∙(3CHCl)4 ∙CO2 = 81∙kC4HCl ∙CO2
Изменение скорости реакции по отношению к первоначальной определяется отношением:

Следовательно, при увеличении концентрации в 3 раза скорость реакции возрастет в 81 раз.
Уменьшение давления в 2 раза равноценно уменьшению концентрации всех газообразных веществ в такое же число раз. Поэтому:

Изменение скорости реакции равно:

Следовательно, при уменьшении давления в 2 раза, скорость данной реакции уменьшится в 32 раза.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на 10° скорость большинства химических реакций возрастает в 2-4раза.
Математическое выражение правила Вант-Гоффа:

где υ1 и υ2 - скорости реакции при температурах Т1 и Т2; g - температурный коэффициент реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на 10°.
Пример 2. Как изменится скорость взаимодействия исходных веществ при повышении температуры с 20 до 66 °С, если температурный коэффициент реакции равен 2,5?
Решение. По условию задачи изменение температуры Т2 – Т1 =
= 66 - 20 = 46°. Следовательно, в результате повышения темпера-
туры на 46° отношение 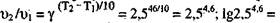
= 4,6 • lg2,5 = 4,6 • 0,398 = 1,831, тогда υ66/ υ20 = 67,7. Скорость реакции возрастает в 67,7 раз.
Пример 3. При 200 °С реакция заканчивается за 10 минут. Сколько времени будет длиться реакция при 100 °С, если температурный коэффициент этой реакции равен 2.
Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость:

где t1 и t2 -время протекания реакции при температурах T1 и T2; υ1 и υ2 - скорости реакции при температурах T1 и Т2.

2.2. Химическое равновесие
Реакции, идущие одновременно в двух противоположных, направлениях (прямом и обратном), называют обратимыми. Для любой обратимой гомогенной реакции:
аА + вВ «сС -dD.
В начальный момент времени, согласно закону действующих масс, скорость прямой реакции: 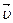 =
=  ∙CaA-CbB, имеет максимальное значение, а скорость обратной реакции
∙CaA-CbB, имеет максимальное значение, а скорость обратной реакции  =
=  -Ccc-DdD равна нулю. Со временем концентрация исходных веществ - реагентов (А и В) уменьшается, а продуктов реакции (С и D) возрастает и, следовательно, уменьшается скорость прямой и возрастает скорость обратной реакции. Наступает момент, когда обе скорости становятся равными (
-Ccc-DdD равна нулю. Со временем концентрация исходных веществ - реагентов (А и В) уменьшается, а продуктов реакции (С и D) возрастает и, следовательно, уменьшается скорость прямой и возрастает скорость обратной реакции. Наступает момент, когда обе скорости становятся равными (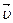 =
=  ), что соответствует равновесному состоянию системы. Концентрации реагентов и продуктов реакции, установившиеся к моменту равновесии, называются равновесными [А], [В], [С], [D], они остаются постоянными до нарушения химического равновесия.
), что соответствует равновесному состоянию системы. Концентрации реагентов и продуктов реакции, установившиеся к моменту равновесии, называются равновесными [А], [В], [С], [D], они остаются постоянными до нарушения химического равновесия.
Равновесное состояние химической системы характеризуется по закону действующих масс константой равновесия (Кр).
Для гомогенной реакции в общем виде выражение Кp имеет вид:

Это выражение позволяет рассчитать Кp по известным равновесным концентрациям всех веществ гомогенной реакции или концентрацию отдельного из веществ по известным концентрациям остальных веществ и КР.
Для гетерогенных реакций в выражение константы равновесия не входят концентрации веществ, находящиеся в конденсированном состоянии ввиду их постоянства. Для гетерогенной обратимой реакции в общем виде:
аА(г) + вВ(к) «сС(к) +dD(г) выражение для константы равновесия имеет вид:

|
Например, для гетерогенной реакции
|

|
При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентрации реагентов на величины DСА и DСВ и увеличение концентраций продуктов на величины DСС и DСо, определяемые выражениями для реагентов:

где С0,(А), С0,(B), С0,(C), С0,(D) - исходные концентрации реагентов и продуктов реакции. Эти выражения позволяют рассчитать равновесные концентрации веществ по начальным концентрациям реагентов при известном значении Кр (и наоборот).
Пример 1. При некоторой температуре константа равновесия
реакции: Н2 (г) + I2 (г) «2HI (г) равна 1. Определите состав равно-
весной реакционной смеси, если для реакции были взяты 1 моль/л
Н2 и 2 моль/л I2.
Решение. Задача сводится к определению равновесных концентраций реагентов и продуктов реакции через константу равновесия. Запишем выражение константы равновесия:

Равновесные концентрации представляют собой концентрации реагентов, не вступивших в реакцию к моменту установления равновесия, и концентрации продуктов реакции, образовавшихся к моменту равновесия. Эти концентрации можно рассчитать из уравнения реакции:
Н2 (г) +I2 (г) «2HI (г).
Начальная концентрация: 1 2 0
К моменту равновесия:
1) прореагировало, ∆С х х
2) осталось 1-х 2-х
3) образовалось 2х
Таким образом, равновесные концентрации исходных веществ и продуктов реакции составляют:
[H2] = CH2-x = (l-x),
[I2] = С12-х = (2-х),.
[HI] = 2х, так как из уравнения видно, что HI образуется в 2 раза больше, чем реагирует Н2 или I2. С0,(H2) и С0, (12) - исходные концентрации Н2 и I2.

|
Подставляя эти значения в выражение константы равновесия, получим:
(второй корень уравнения является отрицательным и физического смысла не имеет).
По достижении равновесия состав реакционной смеси был следующий:
[Н2] = (1 - 0,45) = 0,55 моль/л,
[I2] = (2 - 0,45) = 1,55 моль/л,
[HI] = 2∙0,45 = 0,9 моль/л.
Пример 2. При некоторой температуре в системе 2NO2 (г) «
«2NO (г) + О2(г); равновесная концентрация О2 становится равной 0,2 моль/л, а Кp = 12,8. Определите начальную концентрацию реагента.
Решение. 2NO2 (г) «2NO (г) + О2(г);
ni, моль по уравн. 2 2 1
С0, моль/л? 0 0
[ ], моль/л? 2[О2] 0,2
Со,(N02) = [NO2] + ∆СNO2; ∆CN02= ∆CNO; ∆CNO= [NO] = 2[O2]

Date: 2015-10-21; view: 2035; Нарушение авторских прав