
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Квантовые числа. Решение уравнения Шредингера позволяет найти волновые функции, при этом выяснено, что для полного определения каждого решения необходимы три целых числа –
|
|
Решение уравнения Шредингера позволяет найти волновые функции, при этом выяснено, что для полного определения каждого решения необходимы три целых числа – квантовые числа. Можно сказать, что квантовые числа описывают совокупность движений электронов в атоме.
ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО (n) определяет общую энергию электрона на данной орбитали и принимает значения n = 1, 2, 3, 4….
Чем больше n, тем больше объем внутреннего пространства атомной орбитали, т.е. растет удаленность электрона от ядра атома. Все электроны с одинаковым значением главного квантового числа образуют электронный слой. Приняты следующие обозначения электронных слоев:
Значение n ……………………………. 1 2 3 4 5 6 7
Обозначение слоя (уровня) ………….. K L M N O P Q.
Зная главное квантовое число можно определить максимальное число электронов, которое может находиться на этом уровне по формуле Nе = 2n2.
Возможное число подуровней для каждого электронного уровня численно равно значению n– первый уровень (n = 1) состоит из одного подуровня, второй уровень (n = 2) – из двух и т.д. (табл.3).
ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО (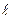 ), которое иногда называют побочным квантовым числом, определяет форму электронного облака и принимает значения от нуля до n-1. Область электронного уровня, в котором содержатся орбитали определенной формы называется энергетическим подуровнем. Подуровень, содержащий s-орбитали, называется s-подуровнем, р-орбитали - р-подуровнем и т.д. Например, при n = 1,
), которое иногда называют побочным квантовым числом, определяет форму электронного облака и принимает значения от нуля до n-1. Область электронного уровня, в котором содержатся орбитали определенной формы называется энергетическим подуровнем. Подуровень, содержащий s-орбитали, называется s-подуровнем, р-орбитали - р-подуровнем и т.д. Например, при n = 1, 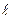 = 0 (на первом уровне существуют только s-электроны). При n = 3,
= 0 (на первом уровне существуют только s-электроны). При n = 3, 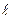 = 0, 1, 2 (на третьем уровне содержит 3s-, 3р- и 3d-электроны).
= 0, 1, 2 (на третьем уровне содержит 3s-, 3р- и 3d-электроны).
Максимальное число подуровней и орбиталей на энергетических уровнях
| Энергетический уровень | Число подуровней | Типы орбиталей | Орбитали, 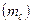
|
| К (n = 1) | 1s | ||
| L (n = 2) | 2s 2p | -1, 0, +1 | |
| M (n = 3) | 3s 3p 3d | -1, 0, +1 -2, -1, 0, +1, +2 | |
| N (n = 4) | 4s 4p 4d 4f | -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
Если 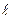 = 0, электронное облако имеет сферическую форму (рис. 5);
= 0, электронное облако имеет сферическую форму (рис. 5);
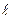 = 1 - электронное облако имеет форму симметричной восьмерки (гантель, рис. 6). С ростом численного значения орбитального квантового числа форма электронного облака усложняется.
= 1 - электронное облако имеет форму симметричной восьмерки (гантель, рис. 6). С ростом численного значения орбитального квантового числа форма электронного облака усложняется.
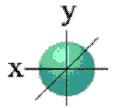

Рис. 6. S-облако. Рис. 7. Р-облака
МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО 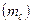 характеризует ориентацию данной орбитали в пространстве. Магнитное квантовое число принимает целочисленные значения от -
характеризует ориентацию данной орбитали в пространстве. Магнитное квантовое число принимает целочисленные значения от - 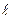 до +
до + 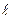 , включая ноль. Например,для
, включая ноль. Например,для 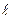 = 2, магнитные квантовые числа имеют значения -2, -1, 0, +1, +2, т.е. в данной подоболочке (d-подуровень) существует пять орбиталей. Соответственно на s-подуровне (
= 2, магнитные квантовые числа имеют значения -2, -1, 0, +1, +2, т.е. в данной подоболочке (d-подуровень) существует пять орбиталей. Соответственно на s-подуровне (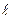 = 0) имеется одна орбиталь; на р-подуровне (
= 0) имеется одна орбиталь; на р-подуровне (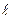 = 1) – три орбитали; на f-подуровне – семь орбиталей. Атомную орбиталь обозначают в виде клеточки □. Тогда число орбиталей на соответствующих подуровнях будет равно: s-подуровень - □; р-подуровнь - □□□; d-подуровень - □□□□□; f-подуровнь - □□□□□□□.
= 1) – три орбитали; на f-подуровне – семь орбиталей. Атомную орбиталь обозначают в виде клеточки □. Тогда число орбиталей на соответствующих подуровнях будет равно: s-подуровень - □; р-подуровнь - □□□; d-подуровень - □□□□□; f-подуровнь - □□□□□□□.
Вышерассмотренные квантовые числа полностью характеризуют три определяющих свойства электрона-волны: длину, направление и амплитуду. Однако у электрона-частицы имеется особое свойство, называемое спином. Упрощенно спин можно рассматривать как вращение электрона вокруг собственной оси. Поэтому в теорию строения атома введено еще одно
СПИНОВОЕ КВАНТОВОЕ ЧИСЛО (ms), которое может принимать два значения в соответствии с двумя возможными направлениями вращения:
ms = + 1/2 (электрон вращается по часовой стрелке вокруг своей оси и имеет обозначение - ↑), ms = - 1/2 (электрон вращается против часовой стрелки вокруг своей оси и имеет обозначение - ↓).
Date: 2015-10-19; view: 438; Нарушение авторских прав