
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулярная физика. Молекулярно-кинетическая теория (МКТ) объясняет строение и свойства тела движением и взаимодействием атомов или молекул тела
|
|
Молекулярно-кинетическая теория (МКТ) объясняет строение и свойства тела движением и взаимодействием атомов или молекул тела.
Основные положения МКТ:
1) Все тела состоят из частиц – атомов или молекул.
2) Эти частицы движутся непрерывно и хаотически.
3) Частицы любого вещества взаимодействуют между собой - притягиваются или отталкиваются.
Опытные обоснования основных положений МКТ:
а) броуновское движение — непрерывное хаотическое движение взвешенных в жидкости частиц, обусловленное ударами молекул жидкости;
б) диффузия — взаимное проникновение молекул одних веществ между молекулами других;
в) проявление сил упругости в газах, жидкостях и твердых телах.
Мерой количества частиц в теле является количество вещества n (моль).
Постоянная Авогадро N A – число молекул, содержащихся в одном моле любого вещества:
N A = 6,02× 1023 моль-1.
Количество частиц определяется выражением:
N = N A n
Молярная масса m— это масса одного моля вещества:
m = m /n, [m] – кг/моль,
где m - масса вещества, n — число молей.
Массу m0 молекулы можно определить по формуле:
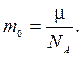
Модель идеального газа
Идеальный газ — модель газа, в которой:
1) молекулы газа не взаимодействуют между собой на расстоянии;
2) при соударении друг с другом и со стенками сосуда молекулы ведут себя подобно упругим шарам;
3) объемом молекул можно пренебречь по сравнению с объемом газа.
При комнатной температуре и нормальном давлении большинство газов можно считать идеальными.
Основное уравнение молекулярно-кинетической теории связывает микроскопические и макроскопические параметры идеального газа:

где р — давление газа; m 0 - масса одной частицы; n = N / V (м-3) — концентрация частиц; r(кг/м3) — плотность газа, v ср(м/с) — среднеквадратичная скорость движения частиц, Е ср (Дж) — средняя кинетическая энергия одной частицы.
Абсолютная температура Т (K) является мерой кинетической энергии хаотического поступательного движения молекул вещества.
T (К) = t °C + 273 К,
где t °С — температура по шкале Цельсия.
Средняя кинетическая энергия Е cp (Дж) поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
 ,
,
где 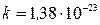 Дж/К — постоянная Больцмана.
Дж/К — постоянная Больцмана.
Среднеквадратичная скорость поступательного движения молекул идеального газа:
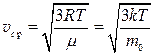 ,
,
где R = 8,31 Дж/(моль×К)— универсальная газовая постоянная, Т — абсолютная температура, m — молярная масса газа, k — постоянная Больцмана, m 0 — масса молекулы.
Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа):
 ,
,
где p - давление, V - объем, n- количество вещества, R — универсальная газовая постоянная, T – абсолютная температура.
Так же это уравнение можно записать в виде:
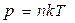
Если количество газа постоянна (n = const) газовый процесс описывается уравнением Клапейрона:
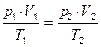
где 1 — начальные параметры газа; 2 — конечные параметры газа.
Изопроцессы в идеальном газе:
Если n = const и T = const — изотермический процесс.
 — закон Бойля – Мариотта (рис. 6).
— закон Бойля – Мариотта (рис. 6).
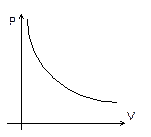
| 
| 
|
| Рис. 6 |
Если n = const и V = const — изохорный процесс.
 — закон Шарля (рис. 7).
— закон Шарля (рис. 7).

| 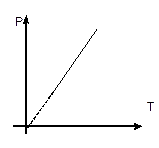
| 
|
| Рис. 7 |
Если n = const и p = const — изобарный процесс.
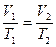 — закон Гей-Люссака (рис. 8).
— закон Гей-Люссака (рис. 8).

| 
| 
|
| Рис. 8 |
Закон Дальтона.
Давление смеси газов равно сумме парциальных давлений каждого газа.
р об = р 1 + р 2 + …+ р n.
Парциальное давление газа — давление данного газа в объеме, занимаемом смесью газов.
Date: 2015-10-19; view: 398; Нарушение авторских прав