
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Равновесий в двухкомпонентных системах
|
|
Проблема классификации бинарных диаграмм фазовых равновесий является одной из важных, но трудно разрешимых проблем физико-химического анализа [7].
В зависимости от характера взаимодействия компонентов различают разные типы двойных систем и их диаграмм состояния. Классификация этих типов нужна, прежде всего, для установления общих связей между различными диаграммами состояния и обоснования их эволюции при изменении физико-химических свойств компонентов и внешних условий. Кроме того, для начинающих изучать диаграммы состояния двойных систем важно их деление на разные группы и последовательность рассмотрения этих групп.
До настоящего времени не предложено какого-либо одного признака, на основе которого можно было бы провести исчерпывающую классификацию двойных систем и их диаграмм состояния.
Материаловеды обычно работают с веществами, находящимися в твердом состоянии, поэтому двойные (и более сложные) системы часто разделяют на две группы в зависимости от того, какие фазы образуются в этих системах: твердые растворы на основе компонентов и промежуточные фазы.
Твердые растворы на основе компонентов могут быть непрерывными или ограниченными (граничными). Промежуточные фазы на диаграммах состояния располагаются между граничными растворами на основе компонентов (или между другими промежуточными фазами, если их несколько в той или иной системе). К промежуточным фазам относятся химические соединения (фазы постоянного состава) и твердые растворы на их основе (фазы переменного состава), а также твердые растворы на основе несуществующих полиморфных модификаций компонентов, образующиеся в результате так называемого концентрационного полиморфного превращения.
Дальнейшее деление систем первой группы может быть проведено с учетом вариантности преобладающего фазового равновесия, в котором участвуют твердые растворы на основе компонентов, а деление систем второй группы - с учетом протяженности области гомогенности промежуточных фаз на диаграмме состояния при заданной температуре.
Следует отметить, что моно- и нонвариантные равновесия встречаются не только в системах с твердыми растворами на основе компонентов, но и в системах с промежуточными фазами, в которых также могут образовываться непрерывные, а чаще - граничные растворы на основе компонентов.
Деление промежуточных фаз на фазы постоянного и переменного состава в значительной степени условно, так как в природе вообще и в металлических системах в частности не встречаются фазы постоянного состава (т.е. определенные химические соединения), а всегда имеются фазы переменного состава, однако часто области гомогенности этих фаз настолько узки (как и области граничных растворов на основе компонентов), что ими можно пренебречь.
Из правила фаз (1.7) следует, что моновариантное равновесие в двойных системах - это равновесие двух фаз (С = 1 при Ф = 2 и К = 2). В зависимости от агрегатного состояния и кристаллической структуры фаз можно представить следующие двухфазные равновесия: L ⇄ α − равновесие жидкого и твердого раствора на основе одного из компонентов; α1 ⇄ α2 − равновесие двух твердых растворов на основе одного или разных компонентов (оба раствора имеют одинаковую кристаллическую структуру и отличаются только химическим составом); α ⇄ β −равновесие двух твердых растворов на основе одного или разных компонентов (оба раствора имеют разную кристаллическую структуру и отличаются химическим составом) и α ⇄ α' − равновесие неупорядоченного и упорядоченного твердых растворов (оба раствора имеют разную кристаллическую структуру и могут отличаться химическим составом).
Отсюда следует, что среди систем с моновариантными равновесиями можно выделить, по меньшей мере, четыре подгруппы систем с одним из перечисленных выше равновесий. К этим равновесиям можно добавить равновесие двух жидких растворов L1 ⇄ L2 на основе одного или разных компонентов, наблюдаемое при ограниченной растворимости компонентов в жидком состоянии (расслоении). Как единственное (преобладающее) равновесие L1 ⇄ L2 в металлических системах не встречается, а всегда предшествует одному из нонвариантных (трехфазных) равновесий.
Согласно правилу фаз (1.7), максимально возможное число равновесных фаз в двойной системе равно трем (С = 0 при К = 2 и Ф = 3). Следовательно, нонвариантное равновесие в двойных системах - это трехфазное равновесие. Любое нонвариантное равновесие, в том числе и трехфазное, характеризуется максимальной устойчивостью – неизменностью внутренних параметров, проявляющейся тем, что, во-первых, реализуется при постоянной температуре и, во-вторых, при неизменных составах всех равновесных фаз.
Характер процессов, происходящих вблизи температуры трехфазного равновесия, удобно проиллюстрировать графически с помощью диаграмм Гиббса – Розебома (рисунок 4.1).
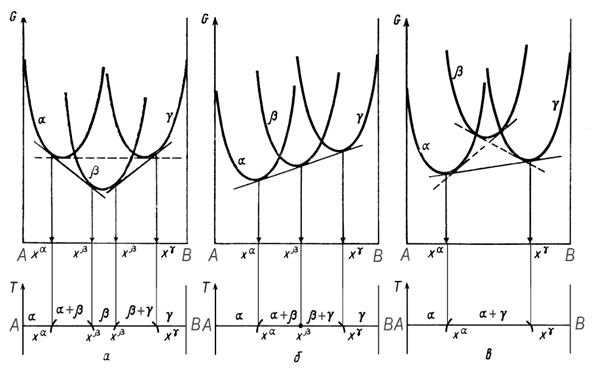
Рисунок 4.1. Изменение взаимного положения кривых Gx вблизи температуры (а и в) и при температуре (б) трехфазного равновесия в бинарной системе А - В
При понижении температуры фазовое равновесие зависит от того, будет ли кривая энергии Гиббса промежуточной по составу β-фазы, отставать от кривых G αи G γ (точнее, от общей касательной к ним) или опережать их [11].

Рисунок 4.2. Два вида трехфазных равновесий в бинарной системе
а- эвтектическое; б – перитектическое.
В первом случае при температуре, превышающей температуру трехфазного равновесия, устойчивость α + β- и β + γ - равновесий окажется выше, чем у 𝛼 + γ(рис. 4.1, а). При снижении температуры возникнет собственно трехфазное равновесие (рис. 4.1, б), которое при дальнейшем понижении температуры сменится равновесием 𝛼 ⇆ γ, а β-фаза становится неустойчивой. Вид полученной диаграммы приведен на рис. 4.2, а.
Для состава, соответствующего х β - в трехфазном равновесии, понижение температуры сопровождается реакцией β ⇄ α + γ, протекающей при температуре трехфазного равновесия. По наиболее изученному представителю (β-фаза - жидкость, α- и γ-фазы - твердые) оно получило название равновесия эвтектического типа, поскольку равновесие L ⇄ α + γ называется эвтектикой. С повышением температуры будут наблюдаться обратные процессы.
Процесс (рисунок 4.2, б), идущий при температуре трехфазного равновесия в сплаве состава х βпри охлаждении, может быть описан так: α + γ ⇄ β. Такое равновесие называют равновесием перитектического типа - по названию превращения L + γ ⇄ β. Других типов трехфазных равновесий в двойной системе быть не может. Соответствующие этим равновесиям графические образы выделены овальной областью на рис. 4.2.
Таблица 1.1
Основные типы нонвариантных фазовых равновесий в бинарных системах
и их графические образы
| № п.п. | Аналитический вид равновесия | Графический образ равновесия | Название равновесия |
| Равновесия эвтектического типа | |||
| 1.1 | L ⇄ α + β | 
| эвтектическое |
| 1.2 | L1⇄ L2 + β | 
| монотектическое |
| 1.3 | β ⇄ α + γ | 
| эвтектоидное |
| Равновесия перитектического типа | |||
| 2.1 | L + γ ⇄ β | 
| перитектическое |
| 2.2 | L1 + L2 ⇄ β | 
| синтектическое |
| 2.3 | β + γ ⇄ α | 
| перитектоидное |
Анализ сказанного позволяет выделить шесть основных видов нонвариантных равновесий, разделив, в свою очередь, на две большие групп: равновесия эвтектического и перитектического типов. К равновесиям эвтектического типа относятся три основных вида: эвтектическое, монотектическое и эвтектоидное. Равновесия перитектического типа объединяют перитектическое, синтектическое и перитектоидное равновесия. Схема этой классификации с представлением графических образов нонвариантных равновесий представлена в таблице1.1.
В двойных системах встречаются следующие нонвариантные равновесия с участием одной или двух жидких фаз: синтектическое L1 + L2 ⇄ α; монотектическое L1⇄ L2 + β; эвтектическое L ⇄ α + β; перитектическое L + β ⇄ α и метатектическое β ⇄ L + α, где α и β - граничные растворы на основе компонентов (или промежуточные фазы).
Синтектическое и метатектическое равновесия в металлических системах встречаются сравнительно редко.
В твердом состоянии возможны следующие нонвариантные равновесия: эвтектоидное α ⇄ β + 𝛾; монотектоидное β1 ⇄ α + β2 и перитек-тоидное β + γ ⇄ 𝛼.
Монотектоидное равновесие напоминает эвтектоидное, но отличается от него тем, что β1- и β2 - растворы имеют одинаковую кристаллическую структуру, но разный химический состав. При температурах выше критической составы этих растворов становятся идентичными.
Date: 2015-10-18; view: 2925; Нарушение авторских прав