
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кислотность и основность органических соединений
|
|
Реакционная способность органических соединений тесно связана с понятиями “кислотность“ и “основность“. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда (протолитическая) и теория Льюиса.
Согласно определению Бренстеда, кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов); основания по Бренстеду – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Кислота Льюиса – это акцептор электронной пары, основания Льюиса – донор электронной пары.
В принципе большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся связи С-Н, N-H, O-H, S-H. Сила кислоты определяется стабильностью аниона, образующегося в результате диссоциации этой кислоты. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от многих факторов:
а) способности атома, связанного с водородом, удерживать электронную пару после ухода протона (т.е. электроотрицательности);
б) размера этого атома;
в) возможности делокализации (распределения отрицательного заряда по другим атомам);
г) способности растворителя сольватировать анион.
В качестве меры кислотности используют константу равновесия реакции ионизации (Ка):
 А ¾ Н
А ¾ Н 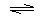 Аˉ + Н+ [ Аˉ] [ Н+]
Аˉ + Н+ [ Аˉ] [ Н+]
 кислота анион про- [АН]
кислота анион про- [АН]
Date: 2015-10-22; view: 539; Нарушение авторских прав