
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окисление металлов катионами других металлов в водных растворах
|
|
Металлы могут окисляться катионами других металлов, если металл поместить в водный раствор соли другого металла с большим электродным потенциалом. Катион-окислитель при этом восстанавливается до металла:
(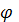 0=+0,34)Cu + 2AgNO3 = Cu(NO3)2 +2Ag(
0=+0,34)Cu + 2AgNO3 = Cu(NO3)2 +2Ag(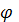 0=+0,8),
0=+0,8),
или до катиона с меньшим зарядом:
Cu + 2FeCl3 = CuCl2 + 2 FeCl2
Окислительно–восстановительный потенциал системы Fe3+/Fe2+(0.77B) выше, чем у системы Cu2+/Cu0 (0.34 В).
В задачах (1132 – 1149) на основании стандартных электродных потенциалов определить возможность протекания реакции.
(см. табл. 4-6).
1032. Zn + CuSO4 →
1033. Zn + CdSO4 →
1034. Zn + NiSO4 →
1035. Zn + FeSO4 →
1036. Mg + TiCl4 →
1037. Mg + ZrCl4 →
1038. Mg + HfCl4 →
1039. Zn + SnSO4 →
1040. Cu + Pd(No3)2 →
1041. K + AlCl3 →
1042. Zn + AgNO3 →
1043. NpF4 + Ba →
1044. Fe + CuSO4 →
1045. Cr + CuCl2 →
1046. Cr + SnCl2→
1047. Cr + NiCl2 →
1048. Mg + UF4 →
1049. Zn + PbCl4 →
При выполнении тестового задания рекомендуется использовать материалы [4].
Тесты. Химические свойства металлов
Вариант 1
1. Какие из указанных ниже металлов будут взаимодействовать с водой при комнатной температуре:
1) Fe, Co, Ni; 2) все металлы, стоящие в ряду напряжений до водорода;
3)Cu, Ag, Au; 4)Ba, Sr, Ca; 5)Be, Al, Mn?
2. Какие продукты образуются при действии воды на магний:
l)MgO,H2; 2)MgH2,О2; 3)Mg(OH)2; 4) Mg(OH)2, Н2; 5)MgО2,H2?
3. Какое соединение алюминия образуется при взаимодействии его с раствором гидроксида калия:
1)А1203; 2)А1(ОН)3; 3)К[А1(ОН)4]; 4) нет ответа; 5)А1Н3?
4. Какие продукты получаются при взаимодействии бериллия с раствором гидроксида калия:
1) Ве(ОН)2, К; 2) К2Ве02, Н20; 3) К2[Ве(ОН)4]; 4) нет ответа;
5) К2[Ве(ОН)4], Н2?
5.Укажите, какой из указанных ниже металлов активнее взаимодействует суксусной кислотой:
l)Cd; 2)Pb; 3) Ag; 4) Hg; 5) нет ответа?
Вариант 2
1. Какой из указанных ниже металлов не растворяется в разбавленной серной кислоте:
1) магний; 2) алюминий; 3) медь; 4) кобальт; 5) хром?
2. Какой продукт окисления золота образуется при его взаимодействии с царской водкой:
l)Au(N03)3; 2)Au203; 3)AuCl; 4) нет ответа; 5)AuCl3?
3. Какие из взятых попарно веществ не будут взаимодействовать друг с другом:
l)Mg + KOH; 2)Cu + HN03; 3)PtCl4 + Cu; 4)Fe + HCl; 5) нет ответа?
4. Между какими веществами (металл + водный раствор) будет протекать окислительно-восстановительная реакция:
1)К20 + КОН; 2)Cd + H20; 3)Fe + KOH; 4) Си + НС1 (конц.); 5)Ва + КОН?
5. Медные пластинки опущены в водные растворы перечисленных ниже солей. С какими солями медь будет взаимодействовать:
1)(CH3COO)2Pb; 2)Sn(N03)2; 3)AgN03; 4) FeCl3; 5) нет ответа?
Вариант 3
1. Никелевые пластинки опущены в водные растворы перечисленных ниже солей. С какими солями никель будет взаимодействовать:
1)ВаС12; 2)PtCl4; 3)FeSO4; 4) А1С13.; 5) нет ответа?
2. Какие из перечисленных ниже металлов пассивируются холодной концентрированной азотной кислотой:
1)хром; 2) медь; 3) магний; 4) нет ответа; 5) цинк?
3. Какие продукты восстановления азотной кислоты наиболее вероятны, если медь взаимодействует с разбавленной азотной кислотой:
1)N02; 2)NO; 3)N20; 4)N2; 5)NH3?
4. До какого продукта восстанавливается концентрированная азотная кислота цинком:
1)Н2; 2) нет ответа; 3)NO; 4)NО2; 5)N2?
5. До какой степени окисления окисляется железо разбавленной соляной кислотой:
1) не окисляется; 2)+6; 3)+3; 4) +2; 5) нет ответа?
Вариант 4
1. В каких из приведенных ниже кислотах можно растворить висмут:
1) СНзСООН (конц.); 2) НС1 (конц.); 3) H2S04 (разб.);
4) HC1 (разб.); 5) H2S04 (конц, горячая)?
2. Какие продукты восстановления серной кислоты наиболее вероятны, если никель взаимодействует с разбавленной серной кислотой:
1)Н2; 2)H2S; 3)SО2; 4) S; 5) нет ответа?
3. В каких из перечисленных ниже кислотах можно растворить золото:
1) НС1 (конц.); 2) 3 НС1 (конц.) + HN03 (конц.); 3) HNOs (конц.);
4) H2S04 (конц.); 5) HN03 (разб.)?
4. До какого продукта восстанавливается концентрированная серная кислота кадмием:
1)Н2; 2)H2S; 3)SО2; 4) S; 5)H2S04?
5. Какое из указанных ниже веществ преимущественно получается при взаимодействии магния с избытком азотной кислоты:
1)N02; 2)NH4N03; 3)NO; 4) NH3; 5) N20?
Вариант 5
1. Какая из указанных ниже реакций является наиболее вероятной
1) Cd + H2SO4 (конц.) → CdSО4 + Н2;
2) Cd + H2SО4 (конц.) → CdSО4 + H2S + H20;
3) нет ответа;
4) Cd + H2SО4 (конц.) → CdSО4 + S + H2О;
5) Cd + H2SО4 (конц.) → CdSО4 + SО2 + Н2О?
2. Какая из указанных ниже реакций является наиболее вероятной
1) Pb + HNО3 (разб.) → Pb(NО3)2 + NО2 + H2О;
2) Pb + HNOs (разб.) → Pb(NО3)2 + NO + H2О;
3) Pb + HNО3 (конц.) → Pb(NО3)2 + N2О + H2О;
4) Pb + HNО3 (разб.) → Pb(NО3)2 + NH3 + H2О;
5) Pb + HNО3 (разб.) → Pb(NО3)2 + N2 + H2О?
3. Какая из указанных ниже реакций является наиболее вероятной
1) Fe + H2SО4 (разб.) → Fe2(SО4)3 + H2О;
2) Fe + H2SО4 (разб.) → Fe2(SО4)3 + SО2 + Н2О;
3) Fe + H2SО4 (разб.) → FeSО4 + SО2 + H2О;
4) Fe + H2SО4 (разб.) → FeSО4 + H2;
5) нет ответа?
4. Какая из указанных ниже реакций является наиболее вероятной
1) Ag + HNО3 (конц.) → AgNО3 + N02 + Н2О;
2) Ag + HNО3 (конц.) → не взаимодействует;
3) Ag + HNО3 (конц.) → AgNО3 + NO + Н2О;
4) Ag + HNО3 (конц.) → AgNО3 + N2 + H20;
5) Ag + HNО3 (конц.) → AgNО3 + NH4NO3 + H2О?
5. Какая из указанных ниже реакций является наиболее вероятной
1) Mg + HNО3 (конц.) → Mg(NО3)2 + N02 + H2О;
2) Mg + HNО3 (разб.) → Mg(NО3)2 + NO + Н2О;
3) Mg + HNО3 (разб.) →Mg(NО3)2 + NH4NO3+ H2О;
4) Mg + HNО3(разб.) → MgO + NO + H20;
5) нет ответа?
Вариант 6
1. Рассмотрите окислительно-восстановительную реакцию
Cu + HNO3(конц.) → Cu(NО3)2 + NО2 + Н2О
Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль азотной кислоты участвует в реакции:
1)8; 2)6; 3) 4; 4)2; 5) нет ответа?
2. Рассмотрите уравнение реакции Cd + H2SО4 (конц.) → CdSО4 + SО2 + H2О Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль серной кислоты участвует в реакции:
1)8; 2)6; 3)4; 4)2; 5) нет ответа?
3. Рассмотрите уравнение реакции Zn + H2SО4 (конц.) → ZnSО4 + H2S + H2О Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль серной кислоты участвует в реакции:
1)10; 2)8; 3)6; 4)4; 5) 5?
4. Рассмотрите уравнение реакции Ag + HNО3 (разб.) → AgNО3 + NO + H2О. Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль азотной кислоты участвует в реакции:
1)2; 2)4; 3)6; 4)8; 5) нет ответа?
5. Рассмотрите уравнение реакции Mg + HNО3 (разб.) → N2 + Mg(NО3)2 + H2О Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль азотной кислоты участвует в реакции:
1)12; 2)10; 3)8; 4)6; 5)4?
Вариант 7
1. Какой из указанных ниже металлов не растворяется в разбавленной серной кислоте:
1) никель; 2) нет ответа; 3) кальций; 4) алюминий; 5)медь?
2. Какое соединение алюминия образуется при взаимодействии его с раствором гидроксида натрия:
1)А12О3; 2)А1(ОН)3; 3)Na[Al(OH)4]; 4) нет ответа; 5)А1Н3?
3. Медные пластинки опущены в водные растворы перечисленных ниже солей. С какими солями медь будет взаимодействовать:
1)Mg(CH3COO)2; 2)SnSО4; 3)AgNО3; 4)ZnCl2; 5) нет ответа?
4. Какие из указанных ниже металлов будут взаимодействовать с водой при комнатной температуре:
1)Na; 2) Си; 3)Fe; 4) нет ответа; 5)Ni?
5. Какие продукты образуются при горении магния на воздухе:
1)MgO; 2)Mg3N2; 3) нет ответа; 4) MgO + Mg3N2; 5)Mg(OH)2?
Вариант 8
1. В каких из перечисленных ниже кислотах можно растворить медь:
1) НС1 (разб.); 2) H2S04 (разб.); 3) СН3СООН (разб.);
4) H2S04 (конц.); 5) нет ответа?
2. Укажите, какой из указанных ниже металлов активнее взаимодействует с уксусной кислотой:
1)Cd; 2)Sn; 3)Fe; 4) нет ответа; 5) Ag?
3. Рассмотрите уравнение реакции А1+HNO3(разб.)→NH4NO3+A1(NO3)3+H2O Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль азотной кислоты участвует в реакции:
1)10; 2)18; 3)24; 4) 30; 5) нет ответа?
4. Рассмотрите уравнение реакции А1 + КОН + Н2О → К[А1(ОН)4] + Н2 Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Сколько моль воды участвует в реакции:
1)2; 2)3; 3)4; 4) 6; 5)8?
5. Закончите уравнение реакции Al + 3 НС1 + HNO3 → АlС13 + NO + Н2O Составьте электронно-ионные уравнения полуреакций для процессов окисления и восстановления, расставьте коэффициенты. Чему равна сумма коэффициентов правой части уравнения:
1)6; 2)4; 3)2; 4) нет ответа; 5) 5?
8.8. Тесты. s-, p-, d-, f – элементы и их соединения
Вариант 1
1. Укажите число электронов на энергетическом уровне n=4 атома стронция.
1) 18; 2) 32; 3) нет ответа; 4) 8; 5) 2.
2. Какая электронная конфигурация соответствует атому магния, находившемуся в возбужденном состоянии
1)1s22s22p6; 2) 1s22s22p63s2; 3) 1s22s2;
4) 1s22s22p63s1; 5) ls22s22p63s13p1?
3. Какому элементу соответствует окончание электронной формулы 4s24p64d5s1
1)Rb; 2)Ca; 3) Sr; 4) К; 5) нет ответа?
4. Какое окончание электронной формулы соответствует иону Ва2+
1)...6s26p6; 2)...5s25p65d26s2; 3)нет ответа; 4)...5s25p65d10; 5)... 5s25p6?
5. Укажите тип гибридизации орбиталей атома магния в молекуле MgCl2
1) нет гибридизации; 2) sp; 3) sp2; 4) sp3; 5) d2sp3.
Вариант 2
1. Какова геометрическая форма [Mg(NH3)6]2+
1) квадрат; 2) пирамида; 3) треугольник; 4) тетраэдр; 5) октаэдр?
2. Какой тип гибридизации проявляется при образовании комплексного иона [Ве(ОН)4]2- и какую пространственную конфигурацию имеет данный ион
1) d2sp3, октаэдр; 2) sp3, тетраэдр; 3) sp3, треугольник;
4) dsp3, пирамида; 5) нет ответа?
3. Какие вещества образуются при сгорании щелочных металлов на воздухе:
1) Na2О2; КО2; Li2О; CsО2; 2) Na2О; Li2О; КО3;CsО3;
3) NaО2;Li2О2;CsО3; K2О; 4) Na2О; Li2О; Cs2О; K2О;
5) Na2О2; LiО3; Cs2О2; K2О2?
4. Укажите оксид, который не растворяется в воде, но растворяется в кислотах и щелочах.
l)MgO; 2)Rb2О; 3)ВеО; 4)ВаО; 5) К2О.
5. Укажите формулу супероксида.
1)ВаО2; 2)К2О2; 3) Li2О; 4)KО2; 5)ВаО.
Вариант 3
1. Атом какого из р - элементов в невозбужденном состоянии имеет электронное строение внешнего энергетического уровня …. 3s23p2xЗр2 yЗр2z
1)N; 2)Ar; 3) Р; 4) S; 5) CI?
2. В каких соединениях сера имеет высшую степень окисления:
a) SO2F2; б) H2S2O3; в) SF6; г) SOCl2; д) Ca(HSO3)2; e) H[SO3C1]
1)а,б,д; 2) б, в, г; 3) г, д, е; 4) а, в, е; 5) а, д, е?
3. В каких соединениях валентные орбитали атома углерода находятся в состоянии sp3- гибридизации: а) СН4; б) С2Н2; в) С2H4; г) С6Н6; д) CF4; е)СС14
1) а, б, в; 2)в, г, д; 3) а, д, е; 4) г, д, е; 5) б, д, е?
4. Оксид серы содержит 60% кислорода. Какова формула это оксида
1)SO3; 2)S2O; 3) SO; 4)S2O3; 5)SO2?
5. Какой объем водорода (н.у.) выделится при растворении 26,96 г алюминия в водном растворе гидроксида натрия
1)22,4 л; 2) 44,8 л; 3) 11,2 л; 4) 67,2 л; 5)33,6л?
Вариант 4
1. Сколько литров метана (н.у.) выделится при растворении молярной массы карбида алюминия в воде
1)22,4 л; 2)67,2л; 3) 44,8 л; 4) 33,6 л; 5) 11,2 л?
2. Чему равна сумма всех коэффициентов в уравнении реакции германия со смесью азотной и хлорводородной (соляной) кислот? Образуется хлорид германия (IV), а окислитель приобретает степень окисления +2
1)28; 2)30; 3)26; 4)34; 5) 32?
3. Свободный висмут образуется при взаимодействии BiCl3 и K2SnO2 в щелочной среде. Сколько молей гидроксида калия необходимо для этой реакции
1)4; 2)8; 3) 6; 4)5; 5)3?
4. Чему равна сумма всех коэффициентов в уравнении реакции сероводорода с сернистой кислотой
1)8; 2)7; 3)6; 4)10; 5) 9?
5. Окисляя сульфид мышьяка (III), азотная кислота восстанавливается до NO2. Сколько молей HNO3 необходимо для окисления молярной массы этого сульфида, если в результате реакции образуются ортомышьяковая и серная кислота
1)28; 2)26; 3)10; 4)24; 5)4?
Вариант 5
1. Какая электронная конфигурация соответствует атому хрома
1)...4d55sl; 2)...4s24p4; 3)...3d54s1; 4)...3d44s2; 5)...4d45s2?
2. Какие степени окисления наиболее характерны для хрома
1) +З и +6; 2) + 2, + 3 и + 4; 3) + 1, + 2, + 4 и + 5; 4) + 4 и + 6; 5) + 2 и + 3?
3. Степень окисления атомов хрома в его комплексных соединениях [Сr(Н2O)6]С13, K3[Cr(CN)6], [Cr(CO)6] соответственно равна:
1) + 3, + 3, + 3; 2) + 6, + 6, + 6; 3) + 2, + 3, + 6; 4) + 3, + 3, 0; 5) + 6, + 6, 0.
4. Какое окончание электронной формулы соответствует иону
хрома Сг3+
1)...3s23p63d54s0; 2)...3s23p6; 3)...3d34s0;
4)нет ответа; 5)...4s24p64d35s0?
5. Укажите тип гибридизации атомных орбиталей, наиболее характерный для хрома:
1) d2sp3 и sp3; 2) sp, sp2 и sp3; 3) только d2sp3; 4) только sp3; 5) нет ответа.
Вариант 6
1. Какой тип гибридизации характерен для комплексных ионов хрома, например [Сr(OН)6]3-? Какую геометрическую форму должны иметь эти ионы
1) sp3, тетраэдр; 2) нет гибридизации, линейная; 3) d2sp3, октаэдр;
4) dsp3, пирамида; 5) dsp2, квадрат?
2. Какой из указанных методов используют для получения чистого хрома в технике:
1) электролиз; 2) нет ответа; 3) гидротермия; 4) карботермия;
5) металлотермия?
3. При взаимодействии хрома с разбавленной серной кислотой образуется:
1)Cr2(SO4)3; 2) CrSO3; 3) СrO3; 4) Сr2O3; 5) не взаимодействует.
4. Какие из перечисленных ниже кислот пассивируют хром
1) НС1 (конц.); 2) HNO3(конц.); 3) HNO3 (разб.); 4) H2SO4 (разб.);
5) нет ответа?
5. Какими свойствами обладает оксид хрома (III)
1) основными; 2) кислотными; 3) амфотерными;
4) несолеобразующий оксид; 5) окислительными?
Вариант 7
1. Какая электронная конфигурация соответствует атому церия
1) [Xe] 4f15d16s2; 2) [Xe] 4f36s2; 3) [Xe] 5d16s2; 4) [Xe] 4f46s2;
5) [Xe] 5d26s2?
2. Впервые лантаноиды были обнаружены финским химиком
Ю. Гадолином в…
1) 1894; 2) 1803; 3) 1794; 4) 1900; 5) 1700 г.?
3. Поскольку у лантаноидов валентными в основном являются 5d16s2 – электроны, их устойчивая степень окисления равна:
1) +2; 2) +3; 3) +1; 4) +4; 5) +6
4. Лантаноидное сжатие – это…
1) Монотонное изменение свойств в ряду Ce – Lu;
2) внутренняя периодичность; 3) внешняя периодичность;
4) постепенное уменьшение в ряду Ce – Lu атомных и ионных радиусов;
5) избирательная периодичность?
5. Прометей обнаружен в продуктах деления ядер урана в атомных реакторах в…
1) 1947; 2) 1942; 3) 1944; 4) 1950; 5) 1952г.?
Вариант 8
1. Какая электронная конфигурация соответствует атому урана
1) [Rn] 5f36d17s2; 2) [Rn] 5f46d17s2; 3) [Rn] 5f67s2;
4) [Rn] 6d17s2; 5) [Rn] 6d27s2?
2. Для соединений актиноидов в водных растворах характерны …
1) гидролиз, полимеризация; 2) комплексообразование;
3) реакции, вызываемые интенсивным облучением;
4) гидролиз, полимеризация, комплексообразование
5) гидролиз, полимеризация, комплексообразование, реакции, вызываемые интенсивным облучением?
3. К растворимым солям актиноидов относятся…
1) нитраты, фториды, сульфаты; 2) нитраты, сульфаты, хлориды, иодиды;
3) нитраты, фосфаты; 4) фториды, фосфаты; 5) сульфаты, хлориды?
4. В степени окисления +3 соединения Th – Np являются сильными восстановителями и разлагают воду...
1) UCl3 + H2O → U(OH)2Cl2 + Cl2 + H2;
2) UCl3 + H2O → U(OH)2Cl2 + HCl + Cl2;
3) UCl3 + H2O → U(OH)2Cl2 + HCl + H2;
4) UCl3 + H2O → U(OOH)Cl2 + Cl2;
5) UCl3 + H2O → U(OH)2Cl2 + H2.
5. Природный уран состоит из трех радиоактивных изотопов 238U(около 99,3%), 235U(около 0,7%) и 234U(около 0,005%). Периоды полураспада их соответственно равны…
1)4,5*109, 7*108, 2,5*105; 2) 4,3*108, 7*106, 2,3*104; 3) 3,9*109, 6*108, 2,3*106; 4) 4,5*105, 7*104, 2,5*103; 5) 4,5*108, 7*107, 2,5*108 лет?
9. БИОЛОГИЧЕСКАЯ РОЛЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
В ОРГАНИЗМЕ
Биологическая роль химических элементов в организме человека чрезвычайно разнообразна.
Главная функция макроэлементов (содержание в организме выше 10-2 %) состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава.
Микроэлементы (содержание в организме находится в пределах от 10-3 до
10-5%) входят в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователей или активаторов, участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсических веществ. Микроэлементы активно влияют на процессы кроветворения, окисления – восстановления, проницаемость сосудов и тканей.
Органы человека по-разному концентрируют в себе различные химические элементы, т.е. микро- и макроэлементы неравномерно распределяются между разными органами и тканями. Большинство микроэлементов накапливаются в печени, костной и мышечной тканях. Эти ткани являются основным депо (запасником) для многих микроэлементов.
Элементы могут проявлять специфическое сродство по отношению к некоторым органам и содержатся в них в высоких концентрациях. Так цинк концентрируется в в поджелудочной железе, иод – в щитовидной, фтор – в эмали зубов, алюминий, мышьяк, ванадий накапливаются в волосах и ногтях, кадмий, ртуть, молибден в почках, олово – в тканях кишечника, стронций – в предстательной железе, костной ткани, барий – в пигментной сетчатке глаза, бром, марганец, хром – в гипофизе и т.д.
Основой для изучения свойств элементов и, в частности, их биологической роли является периодический закон Д.И. Менделеева. Как правило, с увеличением заряда ядра атомов увеличивается токсичность элементов данной группы и уменьшается их содержание в организме. Уменьшение содержания связано с тем, что многие элементы длинных периодов из-за больших атомных и ионных радиусов, высокого заряда ядра, сложности электронных конфигураций, малой растворимости соединений плохо усваивается живыми организмами.
В организме в значительных количествах содержатся легкие элементы s- и p- блоков.
Водород, натрий, калий, магний, кальций – жизненно необходимы для живых и растительных организмов. Изучение p- элементов особенно важно, так как пять из них – С, N, P, O и S – являются органогенными и составляют основу живых систем, а ряд других – F, Cl, I – незаменимые микроэлементы.
Более 1/3 всех микроэлементов организма составляют d-элементы. В биохимических реакциях d-элементы наиболее часто проявляют себя как металлы-комплексообразователи. Белковые молекулы образуют с d-элементами биоэнергетические комплексы – кластеры или биокластеры. Природа регулирует формирование биокластеров с ионами d-элементов определенных размеров. Биокластеры выполняют различные функции. Транспортные комплексы доставляют к органам кислород и необходимые элементы. Другие биокластеры выполняют аккумуляторную (накопительную) роль – это железосодержащие белки: гемоглобин, миоглобин, ферритин. Элементы Zn, Fe, Co, Mo, Cu – жизненно необходимы, входят в состав металлоферментов, катализируя кислотно-основное и окислительно-восстановительное взаимодействие, перенос кислорода.
d-элементы в организме обеспечивают запуск большинства биохимических процессов, обеспечивающих нормальную жизнедеятельность.
При выполнении тестового задания рекомендуется использовать учебное пособие [5].
Date: 2015-09-24; view: 1267; Нарушение авторских прав