
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры составления условий задач и их решения. Задача 1015. Показать, какие продукты образуются при взаимодействии алюминия с водным раствором едкого натрия:
|
|
Задача 1015. Показать, какие продукты образуются при взаимодействии алюминия с водным раствором едкого натрия:
Al + NaOH + H2O →.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона:
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
(тетрагидроксоалюминат натрия).
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород:
2Al+6H2O=2Al(OH)3+3H2↑.
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3+NaOH=Na[Al(OH)4].
Удвоив последнее уравнение и сложив его с предыдущим, получим суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑.
Задача 1027. Показать, какие продукты образуются при сплавлении металла с окислительно-щелочными смесями:
Mo+KOH+O2 →
Раствор щелочи практически на молибден не действует. Молибден может быть переведен в раствор методом окислительного щелочного сплавления с образованием соответствующего молибдата – молибдата калия.
Mo0+KOH+O2 → K2Mo+6O4 +2H2O
 2 4 Mo+8OH- - 6e = MoO42-+4H2O
2 4 Mo+8OH- - 6e = MoO42-+4H2O
3 6 O2+2H2O+4e = 4OH-
2Mo+16OH-+3O2+6H2O → 2MoO42-+8H2O +12OH-
2Mo+4KOH +3O2 = 2 K2MoO4+2H2O.
В задачах (1008-1033) показать, какие продукты образуются при взаимодействии металлов с водными растворами щелочей: при сплавлении с окислительно-щелочными смесями.
| 1008. 1009. 1010. 1011. 1012. 1013. 1014. 1015. 1016. 1017. 1018. 1019. 1020. 1021. 1022. 1023. 1024. 1025. 1026. 1027. 1028. 1029. 1030. 1031. 1032. 1033. | Be + NaOH + H2O → Al + NaOH + H2O → Na3[Al(OH6)] +…. Ga + NaOH + H2O → Sn + KOH + H2O → K2[Sn(OH)4] +…. Sn + NaOH + H2O → Na2[Sn(OH)6] +…. Pb + KOH + H2O →K2[Pb(OH)4] +…. Pb + NaOH + H2O → Na2[Pb(OH)6] +…. Al + NaOH + H2O → Na[Al(OH4)] +… Zn + NaOH + H2O → Si + KOH + H2O → K2SiO3 +…. Ge + KOH + H2O → K2[Ge(OH)6] + … V + KOH + H2O → KVO3 + H2O Nb + KOH + H2O → Ta + KOH + H2O → V + KOH + O2 → K3[VO4] + H2O Nb + KOH + O2 → Ta + KOH + O2 → W + KOH + O2 → Cr + KOH + O2 → Mo + KOH + O2 → Mo + NaOH + NaNO3 → Na2MoO4 + NaNO2 + H2O Ru + KOH + KClO3 → K2RuO4 +…..+…. Os + KOH + KNO3 → Ru + NaOH + KClO → Na2RuO4 + KCl + H2O Os + NaOH + KClO → Te + KOH(t0, кипячение) → K2TeO3 + K2Te + H2O |
8.3. Окисление металлов ионами Н+ в водных растворах
Металлы, имеющие отрицательное значение стандартного окислительно-восстановительного электродного потенциала, вытесняют водород из кислот (HCl, разбавленной H2SO4, CH3COOH и др.) (см. табл. 4)
Mg + 2HCl = MgCl2 + H2.
Разности потенциалов для реакции между магнием и соляной кислотой при условиях близких к стандартным:
E =  -
-  = 0.00 – (-2.34) = 2.34 B.
= 0.00 – (-2.34) = 2.34 B.
Металлы, которые могут иметь различную степень окисления, при взаимодействии с обычными кислотами образуют соли низшей степени окисления:
Fe0 + H2SO4 = Fe+2SO4 + H20.
Образование солей металлов с низшей степенью окисления объясняется сравнительно слабыми окислительными свойствами катионов водорода и более отрицательным значением электродных потенциалов: (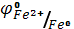 = - 0.44 В) по сравнению с электродным потенциалом (
= - 0.44 В) по сравнению с электродным потенциалом (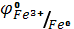 = - 0.04 В).
= - 0.04 В).
Некоторые металлы, имеющие отрицательное значение электродного потенциала, не растворяются в кислотах вследствие образования на их поверхности осадка нерастворимой соли (хлорида, сульфата, карбоната, фосфата). Например, свинец практически не растворяется в соляной и разбавленной серной кислоте, т.к. поверхность металла покрывается осадками хлорида и сульфата свинца.
Металлы, имеющие положительные значения, не могут вытеснять водород из кислот и поэтому с ними не взаимодействуют.
Date: 2015-09-24; view: 881; Нарушение авторских прав