
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры составления условий задач и их решение
|
|
Задача 1041. Составить электронно-ионные схемыи закончить уравнения окислительно-восстановительных реакций взаимодействия металла с кислотами
Cu + HCl → Cu + H2SO4 →
Cu + HCl(р) + O2 → CuCl2 + H2O
Cu + HNO3 → Cu(NO3)2 + NO↑ + H2O
Решение:
 Cu + HCl → Cu + H2SO4 →
Cu + HCl → Cu + H2SO4 →
Находясь в ряду напряжений после водорода, (табл. 4) медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют.
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
 2 Cu – 2e → Cu2+
2 Cu – 2e → Cu2+
1 O2 + 4H+ +4e → 2H2O
Участие кислорода делает раствор более сильным окислителем, так что медь медленно растворяется в соляной кислоте.
Cu + HNO3 → Cu(NO3)2 + NO↑ + H2O
в-ль ок-ль, среда
 3 Cu – 2e → Cu2+ о-е; в-ль
3 Cu – 2e → Cu2+ о-е; в-ль
2 NO3- + 4H+ + 3e → NO + 2H2O в-е; о-ль
3 Cu + 2NO3- + 8H+ = 3 Cu2+ + 2NO↑ + 4H2O
При составлении молекулярного уравнения возникает вопрос, какой коэффициент должен быть поставлен перед азотной кислотой (2 или 8)?
В подобных случаях для правильного решения вопроса нужно руководствоваться следующий: если окислитель или восстановитель одновременно выполняет и функцию среды, то в молекулярном уравнении для данного вещества должен быть взят коэффициент, стоящий перед ионом, который учувствует в реакции в большем количестве.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
В этой реакции 2 молекулы HNO3 реагируют как окислитель, а 6 молекул расходуются в качестве среды – на солеобразование. В реакциях такого типа одно и то же вещество можно вписывать в уравнение дважды.
3Cu +2HNO3 +6HNO3 → 3Cu(NO3)2 +2NO↑ + 4H2O
в-ль ок-ль среда
Задача 1086. Пользуясь методом электронно-ионных полуреакций, закончить составление уравнений
Re + HCl → Re + HF →
Re + H2SO4(к) → HReO4 + SO2 + H2O
Re + HNO3(к) → HReO4+ NO↑ + H2O
Решение:
 Re + HCl → Re + HF →
Re + HCl → Re + HF →
В электрохимическом ряду напряжений располагается после водорода. Стандартный электродный потенциал У0 ReO-4/Re = 0,37В. Re не растворяется в HCl и HF, но реагирует с кислотами, проявляющими сильные окислительные свойства, образуя HReO4.
Re + H2SO4(к) → HReO4 + SO2 + H2O
 2 Re + 4H2O – 7e → ReO4- + 8H+
2 Re + 4H2O – 7e → ReO4- + 8H+
7 SO42- + 4H+ + 2e → SO2 + 2H2O
2Re + 8H2O + 7SO42- + 21H+ = 2ReO4- + 16H+ + 7SO2 + 14H2O
2Re + 7H2SO4(к) → 2HReO4 + 7SO2 + 6H2O
Re + HNO3(к) → HReO4+ NO↑ + H2O
 3 Re + 4H2O – 7e → ReO4- + 8H+
3 Re + 4H2O – 7e → ReO4- + 8H+
7 NO3- + 4H+ + 3e → NO + 2H2O
3Re + 12H2O + 7NO3- + 21H+ = 2ReO4- + 24H+ + 7NO + 14H2O
3Re + 7 HNO3(к) → 3HReO4+ 7NO↑ + 2H2O
К числу особенностей взаимодействия некоторых металлов с концентрированной азотной и серной кислотами относится окисление металлов не до катионов, а до более сложных продуктов, чаще это оксоанионы, в частности ReO4-.
Задача 1112. Закончить уравнение реакции взаимодействия тантала со смесью кислот.
Ta + HNO3 + HF → H2[TaF7] + … + …
Решение:
Тантал отличается высокой химической стойкостью и лучше всего растворяется в смеси азотной и фтористоводородной кислот, переходя во фторидный комплекс
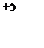 | 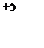 |
Ta0 + HNO3 + HF → H2[TaF7] + NO + H2O
 3 Ta – 5e → Ta+5
3 Ta – 5e → Ta+5
5 NO3- + 4H+ + 3e → NO + 2H2O
3Ta + 5NO3- +20H+ → 3Ta+5 + 5NO + 10H2O
3Ta + 5HNO3 +21HF → 3 H2[TaF7] + 5NO + 10H2O
Тантал лучше всего растворяется в смеси азотной и фтористоводородной кислот, переходя во фторидный комплекс.
В задачах (1034-1105) составить электронно-ионные схемы и закончить уравнения окислительно-восстановительных реакций взаимодействия металлов с кислотами.
| 1034. | As + HC1 → Sb + HC1 → Bi + HC1 → As + Cl2 + H2O → H3AsO4 + HCI As + HN03 + H2O → H3AsO4 + NO |
| 1035. | As + H2SO4(р) →Sb + H2SO4(р) → Bi + H2SO4(р) → Bi + HN03(p) → Bi(NO3)3+ NO + H2O Bi + H2SO4(к) → Bi2(SO4)3 + SO2 + H2O |
| 1036. | Si +HCl(р) → Si + H2SO4(р) → Si + HNO3 → Si + HNO3 + HF → H2[SiF6] + NO + H2O Ge + H2SO4(к) → GeO2 + SO2 +H2O |
| 1037. | Ge + HCl(р) → Ge + H2SO4 → Ge + HNO3(к) → GeO2 + NO2 + H2O Ge + HNO3 + HCl → GeCl4 + NO + H2O |
| 1038. | Sn + HCl(р) → Sn + H2SO4→ Sn + H2SO4(к) → Sn(SO4)2 +SO2 + H2O Sn + HNO3(р) → Sn(NO3)2 + NH4NO3 +H2O |
| 1039. | Sn + HCl(к) → Sn + HNO3(к) → H2SnO3 + NO2 + H2O Sn + HNO3 + HCl → SnCl4 + NO + H2O |
| 1040. | Pb +HCl(р) → Pb + H2SO4(р) → Pb + H2SO4(к) → Pb + HCl(к) → Pb+O2 + CH3COOH → Pb + HNO3(р) → Pb(NO3)2 + NO + H2O |
| 1041. | Cu + HCl → Cu + H2SO4(р) → Cu + HCl(р) + O2 → CuCl2 + H2O Cu + HNO3(30-35%) → Cu(NO3)2 + NO + H2O |
| 1042. | Cu + H2SO4(к) → CuSO4 + SO2 + H2O Cu + HNO3(к) → Cu(NO3)2 + NO2 + H2O Ag + HNO3(к) → AgNO3 + NO2 + H2O |
| 1043. | Ag + HCl → Ag + H2SO4 → Ag + HNO3(р) → AgNO3 + NO + H2O Ag + H2S + O2 → Ag2S + H2O |
| 1044. | Au + HCl → Au + H2SO4 → Ag + H2SO4 → Ag2SO4 + SO2 + H2O Au + Cl2 + HCl → H[AuCl4] |
| 1045. | Au + HNO3 → Au + H2SeO4 → Au2(SeO4)3 + H2 Au + HNO3 + HCl → AuCl3 + NO + H2O |
| 1046. | Be + HCl → Be + H2SO4 → Be+CH3COOH→ Be + HNO3(оч. разб.) →Be(NO3)2 + NH4NO3 + H2O Be + H2SO4(к) → BeSO4 + H2S + H2O |
| 1047. | Mg + HCl → Mg + H2SO4 → Mg + CH3COOH → Mg + H2SO4(к) → MgSO4 + H2S + H2O Mg + HNO3(оч. разб.) → Mg(NO3)2 + NH4NO3 + H2O |
| 1048. | Ca + HCl → Ca + H2SO4 → Ca + CH3COOH→ Ca + H2SO4(к) → CaSO4 + H2S + H2O Ca + HNO3(разб.) → Ca(NO3)2 + N2O +H2O |
| 1049. | Ca + HNO3(оч. разб.) → Ca(NO3)2 + NH4NO3 + H2O Mg + HNO3(разб.) → Mg(NO3)2 + N2O + H2O Ba + H2SO4(к) → BaSO4 + H2S + H2O |
| 1050. | Sr + HCl → Sr + H2SO4 → Sr + CH3COOH → Sr + HNO3(оч.разб.) → Sr(NO3)2 + NH4NO3 + H2O Sr + H2SO4(к) → SrSO4 + H2S + H2O |
| 1051. | Ba + HCl → Ba + H2SO4 → Ba + CH3COOH → Ba + H2SO4(к) → BaSO4 + S + H2O Ba + HNO3(р) → Ba(NO3)2 + N2O + H2O |
| 1052. | Zn + HCl → Zn + H2SO4 → Zn + CH3COOH → Zn + H2SO4(к) → ZnSO4 + SO2 + H2O Zn + H2SO4(к) → ZnSO4 + S + H2O |
| 1053. | Zn + H2SO4(к) → ZnSO4 + H2S + H2O Zn + HNO3(р) → Zn(NO3)2 + N2 + H2O Zn + HNO3(р) → Zn(NO3)2 + N2O + H2O |
| 1054. | Zn + HNO3(оч. разб) → Zn(NO3)2 + NH4NO3 + H2O Cd + HCl → Cd + H2SO4 Cd + CH3COOH→ Cd + H2SO4(к) → CdSO4 + SO2 + H2O |
| 1055. | Cd + H2SO4(к) → CdSO4 + S + H2O Cd + H2SO4(к) →CdSO4 + H2S + H2O Cd + HNO3(р) → Cd(NO3)2 + N2 + H2O |
| 1056. | Cd + HNO3(р) → Cd(NO3)2 + N2O + H2O Cd + HNO3(оч. разб.) → Cd(NO3)2 + NH4NO3 +H2O Hg + HCl → Hg + H2SO4 → |
| 1057. | Hg + CH3COOH → Hg + H3PO4 → Hg + H2SO4(к) → HgSO4 + SO2 + H2O Hg + HNO3(к) → Hg(NO3)2 + NO2 + H2O |
| 1058. | Hg + HNO3(разб. горячая) → Hg(NO3)2 + NO + H2O избыток кислоты Hg + HNO3(разб. холодная) → Hg2(NO3)2 + NO + H2O избыток ртути Zn + HNO3(к) → Zn(NO3)2 + NO2 + H2O |
| 1059. | Al + HCl → Al + H2SO4 → Al + H2SO4(сред. конц.) → Al2(SO4)3 + H2O Al + HNO3(разб.) → Al(NO3)3 + N2 + H2O |
| 1060. | Al + HNO3(очень разб.) → Al + HNO3(к) → Al + H2SO4(оч. конц.) → Al + H2SO4(средн. конц.) → Al2(SO4)3 + S + H2O Ga + HNO3(разб.) →Ga(NO3)3 + N2 + H2O |
| 1061. | Ga + HCl → Ga + H2SO4 → Ga + H2SO4(сред. конц.) → Ga2(SO4)3 + SO2 + H2O Ga + H2SO4(сред. конц.) → Ga(SO4)3 + S + H2O |
| 1062. | In + HCl → In + H2SO4 In + H2SO4(к) → In(SO4)3 + SO2 + H2O In + HNO3(р) → In(NO3)3 + N2 + H2O |
| 1063. | Tl + HCl → Tl + H2SO4 → Tl + H2SO4(к) → Tl2SO4 + SO2 + H2O Tl + HNO3(р) → TlNO3 + N2 + H2O |
| 1064. | Sc + HCl → Sc + H2SO4 → Sc + HNO3 → Sc(NO3) + N2O + H2O Sc + HNO3 → Sc(NO3)3 + NH4NO3 + H2O |
| 1065. | Y + HCl → Y + H2SO4 → Y + HNO3(р) → Y(NO3)3 + N2O + H2O Y + HNO3(р) → Y(NO3)3 + NH4NO3 + H2O |
| 1066. | La + HCl → La + H2SO4 → La + HNO3(р) → La(NO3)3 + N2O + H2O La + HNO3(р) → La(NO3)3 + NH4NO3 + H2O |
| 1067. | Ge + HCl → Ge + H2SO4 → Ge + HNO3(р) → Ge(NO3)3 + N2O +H2O Ge + HNO3(р) → Ge(NO3)3 + NH4NO3 + H2O |
| 1068. | Pr + HCl → Pr + H2SO4 → Pr + HNO3(р) → Pr(NO3)3 + N2O + H2O Pr + HNO3(р) → Pr(NO3)3 + NH4NO3 + H2O |
| 1069. | Sm + HCl → Sm + H2SO4 → Sm + HNO3(р) → Sm(NO3)3 + N2O + H2O Sm + HNO3(р) → Sm(NO3)3 + NH4NO3 + H2O |
| 1070. | Tb + HCl → Tb + H2SO4 → Tb + HNO3(р) → Tb(NO3)3 + N2O + H2O Tb + HNO3(р) → Tb(NO3)3 + NH4NO3 + H2O |
| 1071. | Ac + HCl → Ac + H2SO4 → Ac + HNO3(р) → Ac(NO3)3 + N2O + H2O Ac + HNO3(р) → Ac(NO3)3 + NH4NO3 + H2O |
| 1072. | Th + HF → Th+4 +… Th + H2SO4 → Th+H3PO4 → Th + HCl(конц. горячая) → Th1.3Cl0.7H1.3 комплексный гидрид Th + HNO3(разб.) → Th(NO3)4 + NH4NO3 + H2O |
| 1073. | U + HCl → U + HF → U + H2SO4 → U + HCl(горячая конц.) U + HNO3(разб.) → U(NO3)4 + NH4NO3 + H2O |
| 1074. | Ti + HCl → при разрушении окисной пленки Ti + HNO3 + H2O → H2TiO3 + NO Ti + HNO3(к) → H2TiO3 + NO2 + H2O |
| 1075. | Ti + H2SO4(конц) → H2TiO3 + SO2 + H2O Ti + HF → H2[TiF6] + … Ti + HNO3 + HCl → TiCl4 + NO + H2O |
| 1076. | Zr + HCl → Zr + HNO3 → Zr + H2SO4 → Zr + HF → Zr + H2SO4 + H2O(горяч.) → H4[ZrO(SO4)3] + … Zr + HNO3 + HCl → ZrCl4 + NO + H2O |
| 1077. | Hf + HCl → Hf + HNO3→ Hf + H2SO4→ Hf + HF → Hf + HNO3 + HCl → HfCl4 + NO + H2O |
| 1078. | V + HCl → V + H2SO4 → V + HF → V + HNO3(р) → HVO3 + NO + H2O V + H2SO4(к) → HVO3 + SO2 + H2O |
| 1079. | Ta + HCl → Ta + H2SO4 → Ta + HNO3(к) → Ta + HNO3(р) → Ta + HF → Ta + HNO3 + 3HCl → V + HNO3 + HCl → VCl3 + NO + H2O |
| 1080. | Nb + HCl → Nb + H2SO4 →Nb + HNO3 +HCl →Nb +HF→ Ta + HNO3 + HF → H2[TaF7] + NO + H2O Nb + HNO3 + HF → H2[NbF7] + NO + H2O |
| 1081. | Cr + HCl → Cr + H2SO4(р) → Cr + H2SO4(к) на холоду → Cr + HNO3(р) → Cr +HNO3(к) → Cr + HNO3 + HCl → Cr + H2SO4(к) горячая конц. → Cr2(SO4)3 + SO2 + H2O |
| 1082. | Mo + HCl → Mo + H2SO4 → Mo + H2SO4(к) → H2MoO4 + SO2 + H2O Mo + HNO3(к) → H2MoO4 + NO2 + H2O |
| 1083. | W + HCl → W + H2SO4 → W + HNO3 +HCl → H2[WCl6] + NO + H2O W + HNO3 + HF → H2[WF6] + NO + H2O |
| 1084. | W + HNO3(р) → W + HNO3(к) → Mo + HNO3 + HCl → H2[MoCl8] + NO + H2O Mo + HNO3 + HF → H2[MoF8] + NO + H2O |
| 1085. | Mn + HCl → Mn + H2SO4(р) → Mn + H2SO4(к) → MnSO4 + SO2 + H2O Mn + HNO3(р) → Mn(NO3)2 + NO + H2O |
| 1086. | Re + HCl → Re + HF → Re + H2SO4(к) → HReO4 + SO2 + H2O Re + HNO3(к) → HReO4 + NO + H2O |
| 1087. | Tc + HCl → Tc + HF → Tc + H2SO4(к) → HTcO4 + SO2 +H2O Tc + HNO3(р) → HTcO4 + NO + H2O |
| 1088. | Mn + H2SO4(к) холодная → Mn + H2SO4(к) → MnSO4 + H2S + H2O Mn + HNO3(р) → Mn(NO3)2 + NH4NO3 + H2O |
| 1089. | Fe + HCl → Fe + H2SO4 → Fe + H2SO4(к) → Fe + H2SO4(к) → Fe2(SO4)3 + SO2 + H2O Fe + HNO3(р) → Fe(NO3)3 + NO + H2O |
| 1090. | Fe + HNO3(к) → очень конц. HNO3(пл. 1.4 г/см3), сод. растворенный NO2 Fe + HNO3(р) → Fe(NO3)2 + NH4NO3 + H2O Co + H2SO4(к) → CoSO4 + SO2 + H2O |
| 1091. | Co + HCl → Co + H2SO4 → Co + HNO3(к) → Co + HNO3(р) → Co(NO3)2 + NO + H2O |
| 1092. | Ni + HCl → Ni + H2SO4 → Ni + HNO3(к) → Ni + H2SO4(к) → NiSO4 + SO2 + H2O Ni + HNO3(р) → Ni(NO3)2 +NO + H2O |
| 1093. | Ru + HCl → Ru + HNO3 → Ru + H2SO4 → Ru(губчатый) + HNO3 +HCl → RuCl4 + NO + H2O Rh(губчатый) + HCl(конц.) под давление О2 или в присутствии NaClO4 → |
| 1094. | Rh + HCl → Rh + HNO3 → Rh + H2SO4 → Rh(губчатый) + HNO3 + HCl → H2[RhCl6] + NO + H2O Pd + HCl + O2 → PdCl4 + H2O |
| 1095. | Pd + HCl → Pd + H2SO4 → Pd + H2SO4(к) → PdSO4 + SO2 + H2O Pd + HNO3(р) → Pd(NO3)2 + NO2 + H2O |
| 1096. | Ir +HCl → Ir +H2SO4→ Ir + HNO3 → Ir + HNO3 + HCl → Pd + HCl + Cl2 → Pd + HNO3 + HCl → H2[PdCl6] + NO + H2O |
| 1097. | Os + HCl → Os + H2SO4 → Os + HNO3→ Os + HNO3 + HCl → OsCl4 +NO + H2O Pd + HNO3 + HCl → PdCl4 +NO + H2O |
| 1098. | Pt + HCl → Pt + H2SO4 → Pt + HNO3→ Pt + HCl + O2 → PtCl4 + H2O Pt + HNO3 + HCl → H2[PtCl6] + NO + H2O |
| 1099. | Sb + HNO3(к) → HSbO3 + NO + H2O Bi + HNO3(к) не дымящая → Bi(NO3)3 + NO2 + H2O Sb + H2SO4(к) → Sb2(SO4)3 + SO2 + H2O |
| 1100. | Sn + HCl(к) → HSnCl3 + H2 Ge + HNO3(к) →H2GeO3 + NO2 + H2O Pb + H2SO4(к) → Pb(HSO4)2 + SO2 + H2O |
| 1101. | Pb + HNO3(к) → Pb(NO3)2 + NO2 + H2O Sn + HNO3(р) → Sn(NO3)2 + NO + H2O Au + Cl2 + H2O → H2[AuCl3O] – трихлороксоаурат водорода |
| 1102. | Zn + HCl + H2O → [Zn(H2O)4]Cl2 + H2 Hf + HNO3 + HCl → H2[HfCl6] + NO + H2O V + H2SO4(к) → VOSO4(сульфат ванадила) SO2 + H2O |
| 1103. | Cr + H2SO4(к) горячая → Cr2(SO4)3 + SO2 + H2O Mo + HNO3(к) горячая +H2O → H2MoO7∙H2O↓ + NO Pt + HCl + O2 → H2[PtCl6] + H2O |
| 1104. | Po + HCl → Se + HNO3 + H2O → H2SeO3 + NO Po + HNO3(к) → Po(NO3)4 + NO2 + H2O |
| 1105. | Po + H2SO4 → Te + HCl → Te + HNO3 + H2O → H2TeO3 + NO Au + H2SeO4(к) → Au2(SeO4)3 + SeO2 + H2O |
Date: 2015-09-24; view: 789; Нарушение авторских прав