
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Взаимодействие металлов с водой
|
|
Окисление металлов водой с термодинамической точки зрения может быть охарактеризовано не только энергиями Гиббса образования, но также электродными потенциалами. Элементом – окислителем в воде является водород, окислительная способность которого оценивается, исходя из концентрации гидратированных ионов Н+.
В воде концентрация (точнее активность) ионов Н+ равна 10-7‑ моль/л. Следовательно, электродный потенциал системы 2Н+/Н2 в воде вычисляется по формуле Нернста (t=25 0С)
 = 0.059∙lg
= 0.059∙lg 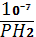 B = (-0.416 – lg PH2)B.
B = (-0.416 – lg PH2)B.
Из формулы видно, что окислительная способность воды тем больше, чем меньше парциальное давление водорода – продукта восстановления воды. При парциальном давлении водорода, равном 1 атм, окислительная способность воды характеризуется потенциалом, равным -0,416 В, т.е. вода может при этом окислять металлы, элетродный потенциал которых меньше этого значения. Однако в реальных условиях парциальное давление водорода гораздо меньше 1 атм, так что можно считать способными окисляться водой все металлы, стоящие до водорода в ряду напряжений.
Необходимо учитывать, что на способность металла реагировать с водой оказывает влияние растворимость в воде оксидных пленок и образующихся гидроксидов металлов.
Из сказанного выше следует, что с водой могут реагировать только металлы:
1) которые могут окисляться водой;
2) оксиды и гидроксиды которых растворяются в воде.
К таким металлам относятся щелочные и щелочноземельные, а также некоторые редкоземельные и актинидные металлы. Лантоноиды очень реакционоспособны. Все металлы непосредственно взаимодействуют с водой, выделяя водород (медленно на холоду, быстро при нагревании). В свободном состоянии лантаноиды по большинству свойств сходны с лантаном (Ge – Eu) или иттрием (Gd – Lu). Гидроксиды скандия и его аналоги имеют основной характер, довольно слабо выраженный у Sc(OH)3, но по ряду Sc – Y – La быстро усиливающийся, так что La(OH)3 является уже сильным основанием. Основность гидроксидов лантаноидов понижается с увеличением атомного номера, как и следует ожидать из уменьшения ионного радиуса:

 ослабление основных свойств Э(ОН)3
ослабление основных свойств Э(ОН)3
Элемент La Ge Pr Nd Pm Sm Eu Gd Tb Dy Ho
Радиус иона Å 1,22 1,17 1,16 1,15 1,13 1,13 1,11 1,09 1,07 1,05

 Er Tm Yb Lu
Er Tm Yb Lu
1,04 1,04 1,00 0,99
Уменьшение радиуса иона Э3+
Актиний является истинным представителем III группы, он отличается от лантана лишь закономерно повышенной активностью. Торий по химической реакционной способности можно сравнить с металлами группы лантаноидов. Реагирует с кипящей водой (см. табл. 5).
Металлы, расположенные в начале ряда напряжения (от лития до алюминия) восстанавливают водород из воды с образованием щелочи. Металлы, менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды (Mn3O4, CrO2, Fe3O4) при высокой температуре (см. табл. 4).
Date: 2015-09-24; view: 967; Нарушение авторских прав