
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задача 290
|
|
Определить константу равновесия обратимой химической реакции
СН4 (г) + H2O(г) ↔ 3 Н2 (г) + СО(г)
при температуре 1000 К.
Как будет смещаться равновесие при повышении температуры и давления?
Решение:
Константа равновесия химической реакции связана со стандартной энергией Гиббса уравнением ΔGo = -RTln Kp = -2,3 RTlg Kp.
Откуда lg Kp = - ΔGo/2,3 RT.
ΔGox.p. = ΔHox.p.- TΔSox.p.
СН4 (г) + Н2O(г) ↔ 3 H2 (г) + СО(г)
| ΔНообр., кДж/моль | - 74,86 | - 241,84 | - 110,52 | |
| Sо, Дж/моль·К | 186,44 | 188,72 | 126,04 | 197,54 |
Находим ΔНох.р.
ΔНох.р. = - 110,52 – [-74,86 +(-241,84)] = 206,18 кДж/моль = 206180 Дж/моль,
Вычисляем ΔSо реакции
ΔSо = (3·126,04 + 197,54) – (186,44+188,72) = 200,5 Дж/моль·К,
Находим ΔGо реакции
ΔGо = ΔНо - ТΔSо = 206180 - 298·200,5=146431 Дж/моль,
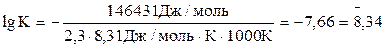 ,
,
откуда К = 2,19·10-8. Большой положительной величине ΔGо соответствует малая константа равновесия.
Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье:
1) так как реакция эндотермическая (Δ Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
2) при повышении давления равновесие будет смещаться в сторону образования меньшего числа молекул, в сторону обратной реакции (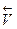 ).
).
Задача 309
В системе А(г) + 2 В(г) = С(г) равновесные концентрации равны:
[A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение:
Константа равновесия данной реакции выражается уравнением
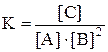 .
.
Подставляя в него данные задачи, получаем 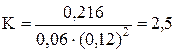 .
.
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моля А и 2 молей В образуется I моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216×2=0,432 моля В. Таким образом, исходные концентрации равны:
[A0] = 0,06 + 0,216 = 0,276 моль/л,
[Во] = 0,12 + 0,432 = 0,552 моль/л.
Date: 2015-09-24; view: 701; Нарушение авторских прав