
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Скорость химических реакций и химическое равновесие
|
|
Химическая кинетика изучает скорость и молекулярный механизм химических реакций. Различают среднюю и истинную (или мгновенную) скорость реакции. Скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени. Реакция в гетерогенной системе осуществляется на поверхности раздела между фазами. Скорость гетерогенной реакции не зависит от площади поверхности раздела между фазами, как и скорость гомогенной реакции не зависит от объема системы.
Для реакции аА + bВ → mМ + nN математическое выражение закона действия масс (1867 г. К.М. Гульдберг, И. П. Вааге) имеет вид
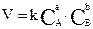 ,
,
где V– скорость реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции (при СA = CB =1 моль/л k численно равна V); СA и CB - концентрации реагентов А и В; а, b - стехиометрические коэффициенты в уравнении реакции.
Так как скорость химической реакции зависит от температуры, то k – величина постоянная только при данной температуре.
Закон действия масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действия масс справедлив для каждой отдельной стадии реакции, но ни для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальная, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действия масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом.
Например, запись аА + bВ → АаВb может быть суммарным уравнением сложного взаимодействия, протекающего по стадиям:
А + В →АВ – самая медленная стадия процесса,
(а – I)А + АВ → АаВ, АаВ + (b-1)В → АаВb.
Закон действия масс запишется так: V = k СА∙СВ. Это соотношение представит зависимость от концентрации реагентов А и В не только скорости первой стадии реакции, но и всего процесса.
Химическая реакция не всегда «доходит до конца», другими словами, исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакций могут создаться условия для протекания реакции в противоположном направлении.
Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми.
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием. Для обратимой химической реакции, записанной в общем виде
mA + nB ↔ qD + pC,
константа равновесия выразится уравнением
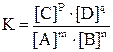 .
.
Уравнение представляет собой математическое выражение закона действия масс при химическом равновесии.
Равновесие обратной реакции может быть нарушено воздействием внешних условий, например изменением концентрации, давления или температуры. Все разнообразные эффекты внешних воздействий на изменение равновесия могут быть обобщены в виде следующего правила, впервые сформулированного в 1884 г. французским химиком Ле-Шателье. Внешнее воздействие (изменение концентрации, давления или температуры) на систему, находящуюся в состоянии равновесия, вызывает сдвиг равновесия в том направлении, при котором частично компенсируется влияние этого воздействия.
Это правило называется принципом Ле-Шателье, или принципом подвижного равновесия.
Date: 2015-09-24; view: 739; Нарушение авторских прав