
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способность S-слоев к самосборке и практическое применение
|
|
Изолированные субъединицы S-слоев или фрагменты S-слоев как грамположительных, так и грамотрицательных бактерий обладают уникальной способностью вновь самоорганизовываться на поверхностных структурах клеток, с которых они были выделены, или на других "подходящих" поверхностях (Nomellini et al., 1997). Показано, что субъединицы S-слоев могут связываться с липид-липополисахаридным комплексом, с белками внешней мембраны, с пептидогликаном или с ассоциированными с пептидогликаном нейтральными полисахаридами. Такое связывание осуществляется путем гидрофобных взаимодействий, водородных связей или прямыми электростатическими взаимодействиями (Sara et al., 2000).
После удаления реагента, использовавшегося для выделения S-cлоя, отдельные субъединицы сохраняют способность к самосборке in vitro в регулярные структуры, сходные с нативными S-слоями. Для самосборки S-слоев in vitro в ряде случаев не требуется никаких дополнительных факторов. Однако чаще всего удаление хаотропного агента оказывается недостаточным для инициации самосборки. Обычно для этого процесса необходимы ионы двухвалентных металлов. Следует отметить, что это в большей степени характерно для грамотрицательных бактерий (Nomellini et al., 1997; Graham et al., 2005). Для Caulobacter crescentus показано стимулирующее влияние на процесс самосборки ионов кальция. Но оказалось, что кальций мог быть заменен стронцием, а также, но в меньшей степени, кобальтом, барием, марганцем и магнием. Ионы никеля и кадмия оказывали лишь незначительное влияние на процесс самосборки S-слоев. Ионы цинка, железа и одновалентных металлов не оказывали заметного воздействия на реассоциацию белковых субъединиц. Хотя in vitro Ca2+ мог быть заменен другими ионами, предполагается, что он играет важную роль в биогенезе S-слоев, так как штаммы Caulobacter сrescentus, способные расти на безкальциевой среде в этих условиях не синтезировали белки S-слоя (Walker et al., 1992).
При культивировании Haloferax volcanii DS2 на среде, не содержащей Mg2+, происходила потеря клетками S-слоев, и, соответственно, резкое увеличение в культуральной среде содержания белка, из которого состоят S-слои данного организма, (Eichler, 2001). По-видимому, в отсутствии Mg2+ у H. volcanii нормальная сборка S-слоев и заякоривание отдельных гликопротеиновых субъединиц затруднены, или даже невозможны.
Кроме ионов металлов, для нормальной сборки S-слоев необходимо наличие гидрофобной поверхности, на которой, собственно, и происходит реассоциация отдельных субъединиц в протяженные регулярные структуры. В качестве такой подложки могут выступать компоненты клеточной стенки бактерий. При этом S-слои одних организмов реассоциируют только на клеточных стенках тех микроорганизмов, из которых они были изолированы, хотя часто для этого подходят полимеры клеточных стенок других организмов. Также в качестве подложки, необходимой для самосборки S-слоев, применяют искусственные липидные мембраны, липосомы, либо подложки из небиологических гидрофобных полимеров.
Оказалось, что на самосборку S-слоев Bacillus stearothermophilus PV72/p2 in vitro влияет содержание вторичного полимера клеточной стенки (SCWP). При увеличении количества SCWP, добавленного к белку S-слоя с 10 до 120 µг/мг белка, процент самосборки в растворе уменьшился от 90 до 10%. SCWP способствовал сохранению белка в растворимом состоянии, однако на поверхностях из нейтрально заряженных полимеров происходила сборка S-cлоев. При этом отдельные субъединицы взаимодействовали с поверхностью подложки своей "внешней поверхностью", в то время как N-концевая область белка, в которой находился SLH-мотив ассоциированный с SCWP, была обращена в раствор (Sаra et al., 1998).
Периодичность белковых субъединиц в решетке и размер пор S-слоев измеряются единицами нанометров, т.е. это наноструктуры. Это свойство предполагает возможность практического применения S-слоев (Sara et al., 2001). S-слои можно использовать для создания ультрафильтрационных мембран с порами одинакового размера; для создания наносфер; для конструирования носителей эпитопов в определенного типа вакцинах; для создания высокочувствительных сенсоров путем закрепления антител или других молекул в узлах кристаллической решетки; наконец, можно методом литографии перенести рисунок пор S-слоя на твердый носитель.
Ультрафильтрационные мембраны, созданные из S-слоев, выгодно отличаются от других типов мембран тем, что каждый тип пор в этом слое имеет строго одинаковую форму и размер, а в случае других мембран распределение пор по размеру колеблется вокруг некой средней величины. Созданы и испытаны ультрафильтрационные мембраны на базе S-слоев бацилл, главным образом Bacillus stearothermophilus (Sara, 2001). Размер пор в таких мембранах составляет 2-8 нм для разных видов и штаммов бацилл (Sleytr et al., 1999)
Мембраны, полученные из изолированных фрагментов S-слоев бактериальных клеток (около 500 нм в диаметре), наслаивают на микрофильтрационную мембрану. Далее S-слои закрепляют на подложке путем их обработки глутаральдегидом (Sleytr et al., 1999). Мембраны можно сделать также, проводя сшивку глутаральдегидом самих фрагментов S-слоя, без использования подложки (Sara et al., 1992). Поры таких мембран обладают низкой неспецифической сорбцией по отношению к различным белкам (Sleytr et al., 1997); эти мембраны препятствуют прохождение белков с определенным молекулярным весом. Для мембран из В. stearothermophilus эта граница проходит между молекулярным весом 35 и 40 кДа (Sara et al., 2001).
Столь же перспективно использование S-слоев как иммобилизационных матриц. Предполагается, что регулярное расположение и одинаковая ориентация белковых субъединиц S-слоев при ковалентном присоединении к ним биологически активных молекул приведет к их плотной упаковке и регулярному расположению на поверхности. Это предположение оказалось справедливым с точностью до отклонений, вызываемых химическими процессами сшивки. В качестве матриц для иммобилизации используют либо ультрафильтрационные мембраны, описанные выше, либо микрочастицы размером 1-2 мкм, полученные ультразвуковым дроблением оболочек клеток микроорганизмов.
Такие частицы, получившие название SMP (S-layer micro-particles), представляют собой пептидогликан, покрытый с двух сторон решеткой S-слоя (Sara et al., 1996). Иногда используют и иммобилизацию на S-слое, рекристаллизованном на подходящей поверхности (Sara et al., 2001). Опыты по мобилизации на таких матрицах ферритина, белка А стафилококков, ряда ферментов (глюкозоксидазы, 3-галактозидазы, инвертазы) показали, что с одной субъединицей S-слоя связывается от 2 до 3 молекул белка, что, примерно, составляет монослой. Ферменты при иммобилизации сохраняют до 60% первоначальной активности, но использование гибких спейсеров (например, 6-аминокапроновой кислоты) способствует более полному сохранению активности ферментов (Kupcu et al., 1995).
Для амперометрических биосенсоров, позволяющих определять глюкозу и сахарозу в растворе, электрический контакт с чувствительным слоем (содержащим глюкозооксидазу и инвертазу, иммобилизованные на S-слое) создается путем наслаивания тонкого листа золота между чувствительным слоем и твердой подложкой. У оптического биосенсора чувствительный слой нанесен на кончик оптического волокна (Neubauer et al., 1996).
Применение S-слоев в качестве матриц для биосенсоров дает определенные преимущества перед обычно применяемыми материалами. Высокая плотность упаковки и расположение молекул фермента в виде монослоя обеспечивает высокую чувствительность и короткое расстояние для диффузии субстрата и продуктов реакции. Это в свою очередь уменьшает время ответа и повышает отношение сигнал/шум (Sara et al., 1996).
Хотя к настоящему времени созданы сенсоры, размер которых около 1 мкм, техника позволяет перейти на чувствительные поверхности размером в десятки нанометров (Pum et al., 1999). Стадия химического присоединения биологически активных молекул к S-белкам приводит к ряду нежелательных последствий. Поскольку химические реакции не абсолютно специфичны, 100%-ного присоединения целевых молекул к субъединицам S-слоя не происходит. Это приводит к тому, что плотность биомолекул на поверхности S-слоя становится недостаточной, а их расположение нерегулярным.Все эти трудности можно преодолеть путем создания гибридных молекул, где целевой белок или олигопептид был бы встроены в структуру S-белка таким образом, чтобы не нарушить способность субъединиц S-белка к самосборке. Несмотря на очевидность, работы по созданию и исследованию таких структур начаты недавно (Ilk et al., 2002).
В подобных исследованиях надо найти такие точки в белке, вставки в которые не мешали бы самосборке S-слоя и позволяли встроенной последовательности экспонироваться на поверхности S-слоя. Показано, что S-белок SbpA Bacillus sphearicus CCM2177 длиной в 1268 аминокислот присоединяется к клеточной стенке своим N-концом, содержащим SLH-элементы. Делеция 200 аминокислот с С-конца не влияет на способность SbpA к самосборке. Исходя из этих наблюдений, созданы и экспрессированы в Е. coli две конструкции, где к целому гену sbpA или гену с делецией 600 п. н. с С-конца присоединяли фрагмент ДНК, который кодирует пептид (Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly), обладающий высоким сродством к стрептоавидину (Strp-tagI). Оба гибридных белка сохраняли способность к самосборке в S-слои, но во втором белке
(с делецией) способность связывать стрептоавидин оказалась намного выше. По-видимому, стерическая доступность пептида Strp-tagI в этом случае выше (Ilk et al., 2002).
Очищенные гибридные белки при диализе начинают полимеризоваться в растворе, образуя плоские двухслойные структуры с линейными размерами около 2мкм. В этих структурах индивидуальные S-слои взаимодействуют друг с другом гидрофобными участками, которые взаимодействуют с клеточной стенкой. Точно также ведет себя и SbpA - белок дикого типа. Если реконструировать S-слой из гибридных белков на поверхности пристеночных чехлов родительских клеток, то образуется S-слой с геометрией, подобной нативному (Ilk et al., 2002).
В следующей работе был использован белок S-слоя Geobacillus stearothermophilus PV72/P2, кодируемый геном sbsB. Этот белок из 889 аминокислотных остатков при реконструкции на липосомах или на других твердых плоскостях ориентирован так, что его внутренняя поверхность смотрит в сторону растворителя. Следовательно, желательно иметь два типа гибридных белков, с тем, чтобы один из встроенных белков (пептид) экспонировался бы на внутренней, а другой - на внешней стороне S-слоя (Sara et al., 1996). Целью работы было создание конструкций, экспонирующих на поверхности S-слоя стрептоавидин (Moll et al., 2001), что позволяет присоединять любые биотинилированные молекулы. Делеции в SbsB-белке с N-конца не препятствуют самосборке, но делеция даже 15 аминокислот с С-конца прекращает самосборку. Получены гибридные генные конструкции, содержащие последовательности, кодирующие стрептоавидин, как на N-, так и на С-конце гена sbsE. Эффективность этих гибридных структур при экспрессии в клетках Е. coli составляет около 50 мг гибридного белка на 1 литр культуры. Так как стрептоавидин - это гомотетрамер, то перед рекристаллизацией S-слоев гибридный белок смешивался со стрептоавидином в отношении 1:3. При этом N-концевые гибриды легко собираются на липосомах или кремниевой поверхности, но С-концевые не обладают такой способностью (рис. 9), а могут формировать S-слои только на клеточной стенке (чехлы клеток родительских бактерий) (Moll et al., 2001).
|
|
|
|
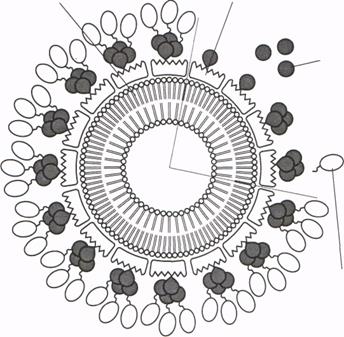
Рис. 3. Схема гибридного S-слоя на поверхности липосомы. В гибридном белке стрептоавидин, выделенный черным цветом, встроен в S-белок бактерии Geobacillus stearothermophilus PV72/P2 (Moll et al., 2001). Так как стрептоавидин существует в виде гомотетрамера, то при реконструкции S-слоя на липосомах гибридный белок смешивают со свободным стрепто-авидином в пропорции 1: 3. С каждой молекулой гибридного белка на поверхности липосомы связывается 3 молекулы биотинилированного белка. Для связывания четвертой молекулы существуют стерические препятствия.
Приведенные результаты (Moll et al., 2001; Ilk et al., 2002) дают возможность строить поверхности с регулярной и высокоплотной упаковкой биологически активных молекул, что может найти применение для создания биосенсоров различного назначения.
Гетерологичная экспрессия химерных S-белков может быть использована для создания живых вакцин. Особенно удобно использовать молочнокислые бактерии, которые давно применяются в пищевой промышленности и считаются безопасными. К таким бактериям относится Lactobacillus brevis, которая имеет многие свойства, делающие этот вид лактобацилл перспективным в качестве пробиотика и транспортной системы, способной доставлять антигены в организм животных и человека. L. brevis устойчива при низких значениях рН к желчным кислотам, способна длительно сохраняться в кишечном тракте.
S-слой L. brevis определяет способность представителей этого вида к адгезии на эпителиальных клетках (Hynonen et al., 2002). При исследовании профилей гидрофильности S-белка L. brevis SlpA обнаружилось, по крайней мере, 4 сайта повышенной гидрофильности, которые, в случае, если они находятся на поверхности белка, могут оказаться подходящими для внедрения чужеродных пептидов. Экспериментальная проверка подтвердила, что, по крайней мере, два сайта - Lys249-Ala250 и Ala313-Asn314 - подходят для этих целей. В эти сайты были вставлены эпитопы полиовируса VPI (10 аминокислот) и продукта протоонкогена человека с-Мус (11 аминокислот). Гибридные SlpA-белки образуют на поверхности L. brevis S-слои с той же геометрией, что и дикий тип, и экспонируют на своей поверхности клонированные эпитопы (Avall-Jaaskelainen et al., 2002). Эффективность такой иммунизации еще предстоит определить.
S-слои попадают в сферу интересов нового направления исследований, называемого нанобиотехнологией. В этом подходе классические биологические макромолекулы - белки, нуклеиновые кислоты, липиды - рассматриваются не с точки зрения их биологической функции, а с точки зрения возможности их использования в создании наноструктур и новых материалов (Sarikaya et al., 2003).
Date: 2015-09-24; view: 801; Нарушение авторских прав