
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Системы поглощения меди у метанотрофов. Метанобактин
|
|
Метанотрофы должны иметь эффективный механизм обнаружения и связывания меди поскольку клетки, экспрессирующие мММО, постоянно нуждаются в этом катионе (Phelps et al., 1992). Этот механизм должен иметь возможность конкурировать с другими Сu-комплексообразующими агентами, присутствующими в поверхностных и подземных системах почвы, тем более что многие метанотрофы зависят от мММО при окисления метана. В частности, в подземной среде биодоступность меди может снижаться при ее взаимодействии с органическим веществом (например, с гуминовыми кислотами) и сорбцией на поверхности оксидов металлов почв. Первое предположение о существовании специфических систем поглощения Сu было представлено по фенотипическим характеристикам мутантов в Мs. trichosporium ОВЗb, имеющих только pMMO (DiSpirito et al., 1998).
Внеклеточным Сu-комплексообразующим агентом у метанотрофов является низкомолекулярное соединение – метанобактин (Cu-Мб),впервые обнаруженный у Мs. trichosporium ОВЗb (Phelps et al., 1992). Метанобактин функционально аналогичен сидерофору железа у других бактерий (Semrau et al., 2010). Метанобактин накапливался в ростовой среде Мs. trichosporium ОВЗb при концентрации меди <0,7 µМ и быстро поступал внутрь клетки при концентрациях меди 0,7 – 1,0 µМ, что совпадало с подавлением экспрессии pMMO и индукцией высокого уровня экспрессии мММО (El Ghazouani A. et al., 2011; Graham, Kim, 2011). Метанобактин обнаружен также у Мc. сapsulatus Bath (DiSpirito et al., 1998; Ali et al., 2009; Semrau et al., 2010).
После успешной разработки метода очистки (Graham et al., 2005) у Мs. trichosporium ОВЗb была получена кристаллическая структура метанобактина (Graham, Kim, 2011). Сu-Мб, выделенный из Мs. trichosporium ОВЗb, имеет м.м. 1217 Да, состоит из семи аминокислот и двух хромофорных остатков, участвующих в связывание меди и следующий химический состав: C45Ni2O4H62S5Cu (Graham et al., 2005). Аминокислотные и неаминокислотные функциональные группы присутствуют в следующей последовательности (N-2-изопропиловый эфир- (4-тионил-5-гидроксиимидозолат)- Glyl- Ser2- Cys3-Туг4-пирролидин-(4-гидрокси-5-тионилимидозолат)- Ser5-Cys6-Met7) (рис. 5).
Два остатка цистеина формируют дисульфидный мостик. Природа белка напоминает многие сидерофоры железа, что привело к замене терминов медь-связывающих соединений (СВС) или медь-связывающих лигандов (CBL) на термин метанобактины, их также называют “chalkophore” («chalko» по-гречески - медь; «sidero» по-гречески - железо) (Semrau et al., 2010).
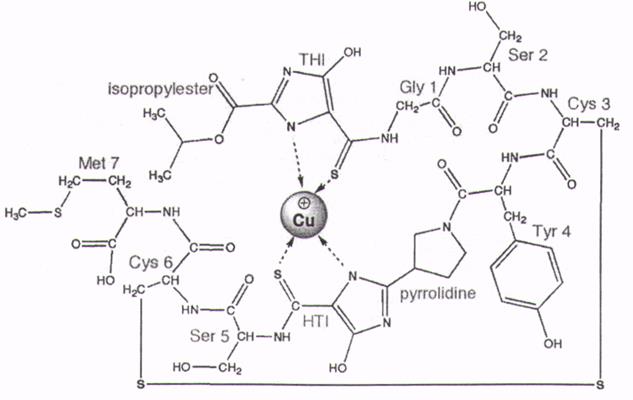
Рис. 5. Cтруктурa медь-связывающего метанобактина, выделенного из Methylosinus trichosporium OB3b (Graham et al., 2005).
Метанобактин принимает пирамидообразную форму с ионом меди в основании пирамиды. Ион меди является «открытым», но обеспечивается некоторая защита изопропилэфирными группами. Фрагменты, 4-тионил-5-гидрокси-имидозолятный (ТТЛ) и 4-гидрокси-5-тионил-имидозолатный (HTI), каждой из групп предоставляют один атом азота и один атом серы лигандов, в результате искаженной тетраэдрической координационной геометрии Cu-N расстояние составляет 2,00 и 2,05 А, а расстояние Cu-S – 2,38 и 2,39 А (El Ghazouani A et al., 2011)
После связывания с метанобактином Cu(II) переходит в состояние Cu(I). Недавно исследовательская группа Уоррена Галлахера из Университета Висконсина сообщила, что в структуре метанобактина содержатся оксазолоновые кольца (а не гидросиимидазолатные, как сообщалось ранее) и 3-метилбутаноильный фрагмент (а не изопропилсодержащая сложноэфирная группа) (Liu et al., 2011).
На основании данных рентгеновской фотоэлектронной спектроскопии (XPS) было предположено, что медь присутствует в виде иона Cu(I), а методом рентгеновского поглощения вблизи края спектра (XANES) установлено, что переход 1s—>4р в 8985 эВ характерен для иона Cu(I) и не относится к Cu(II). Слабый сигнал, полученный методом электронного парамагнитного резонанса (EPR), наблюдали у метанобактина Мs. trichosporium ОВЗb, но его параметры были более совместимы с ионом Cu(II), координирующем лиганды кислорода/азота, а не лиганды серы. Также сигналы EPR, улавливающие ион Cu(II), координирующий азот/серу, наблюдали при титровании с небольшим количеством Cu(II), но эти сигналы исчезали в течение 10 мин. Таким образом, метанобактин всегда содержит Cu(I), независимо от его первоначальной валентности Cu(II) или Cu(I). Как метанобактин понижает валентность Cu(II) до Cu(I), неизвестно, но предполагается, что это происходит из-за формирования дисульфидных связей (Graham et al., 2005).
Анализом изотермической калориметрии (ITC) обнаружено, что метанобактин М. trichosporium ОВЗb связывает Сu как тетрамер с начальной константой связывания 3,3х1034±3,0х1011М-1, что на ~17-19 порядков выше связи с другими металлами. Проводились исследования, в которых сравнивались константы связывания меди метанобактином с уже известными константами связывания меди, имеющими значения до 1030, других соединений, что подтвердило очень высокое значение константы связывания меди метанобактином. При соотношении Cu(II): метанобактин более 0, 25, медь координируется как димер и константа связывания понижается до 2,6±0,46х108, затем медь координируется, как мономер с константой связывания 1,4±0,2х106 при соотношении Cu(I): метанобактин выше 0,5 (Graham et al., 2005).
Другие металлы имели на 4 порядка более низкие средние константы связывания. Несмотря на высокую начальную константу связывания, за которой следует константа связывания ниже при более высоком соотношении медь: метанобактин, это согласуется с его потенциальной ролью в доставке меди из окружающей среды.
В условиях отсутствия Cu(II) или Cu(I), метанобактин может связывать другие металлы, такие, как Ag(I), Au(III), Co(II), Cd(II), Fe(III), Hg(II), Mn(II), Ni(II), Pb(II), U(VI) или Zn(II). Однако метанобактин не связывает Ba(II), Ca(II), La(II), Mg(II) и Sr(II). Полученные результаты свидетельствуют о том, что такие металлы, как Ag(I), Au(III), Hg(II), Pb(II) и, возможно, U(VI) связываются аналогичным механизмом (Semrau et al., 2010).
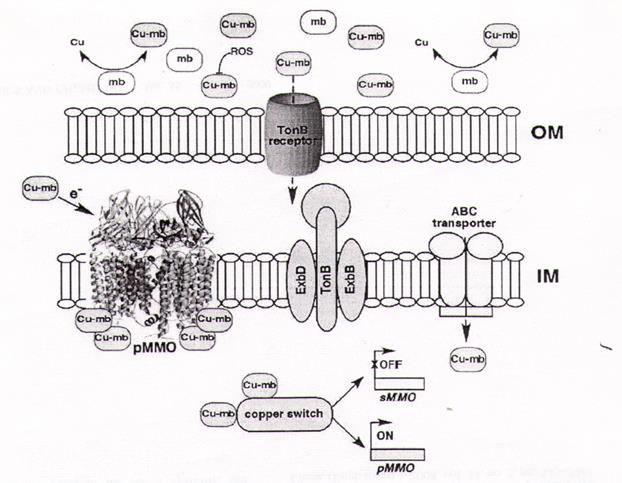
Рис. 6. Возможные функции медь-связывающего метанобактина и предполагаемый механизм поглощения (Graham et al., 2005):метанобактин участвует во внеклеточном поглощении меди для защиты клетки от АФК. Медь-связывающий метанобактин периплазматического пространства может быть вовлечен в каталитическую активность рММО. В цитоплазме Cu-МБ может участвовать в медь-зависимой регуляции ММО. Cu-МБ может быть узнан и транспортирован во внутреннее пространство ТопВ-рецептором интегральной внешней мембраны (ОМ), встроенными TonB-ExbB-ExbD белками и ABC-переносчиком внутренней мембраны (IM).
Метанобактин играет важную роль в поглощении меди (Phelps et al., 1992). Выраженный эффект наблюдали при одновременном добавлении меди и метанобактина в питательную среду Мs. trichosporium ОВЗb в изменяющихся условиях: от недостатка меди до ее концентрации 10 мкМ (Fitch et al., 1993). При внезапном увеличении уровня меди значительно сокращалась lag-фаза, и клетки росли быстрее. Кроме того, метанобактин снижает токсичность меди. Роль метанобактина в подавлении токсичности меди наблюдали в экспериментах по влиянию СuСl2 и метанобактина на количество транскриптов 16S рРНК. Только добавление меди в присутствии метанобактина (в соотношении 1:1) предотвращало резкое снижение количества транскриптов 16S рРНК. Этот защитный эффект мог возникнуть из-за активности супероксиддисмутазы метанобактина (Graham, Kim, 2011).
Способность метанобактина облегчать поглощение меди из различных источников исследовали также путем учета количества транскриптов рmоА (мММО) и mmoХ (рMMO). Когда медь добавляли в виде СuСl2, количество транскриптов рmоА увеличилось, а количество транскиптов mmоХ незначительно уменьшалось, при этом экзогенный метанобактин отсутствовал. Если медь добавлялась в качестве синтетического медь-содержащего оксида Fe или Cu-содержащего боросиликатного стекла, то при добавлении метанобактина наблюдали увеличение транскриптов рmоА и снижение транскриптов mmоХ.
Таким образом, метанобактин может сделать медь более доступной, если она присутствует в качестве нерастворимого минерала (El Ghazouani et al., 2011). Метанотрофы могут оказывать влияние на выветривание минералов, синтезируя метанобактин. Аналогичным образом сидерофоры бактерий и растений могут способствовать растворению железосодержащих минералов. Эти исследования представляют собой важный первый шаг к пониманию функций метанобактина, не только в физиологии метанотрофов, но и как игрока в глобальном цикле углерода.
Неизвестно, как метанотрофы усваивают метанобактин. У грамотрицательных бактерий посредниками для узнавания и поглощения сидерофоров являются ТоnВ-зависимые рецепторы. Транспорт через наружнюю обусловлен цитоплазматическим мембранным комплексом TonB-ExbB-ExbD. TonB-зависимая система была обнаружена в Helicobacter рylori. Транспорт в цитоплазму осуществляется периплазматическим связывающим белком и АВС-переносчиком. Предполагается, что подобный механизм существует для узнавания и поглощения метанобактина (рис. 6) (Graham et al., 2005).
В геноме Мс. capsulatus Bath имеется шесть ОРС, которые соответствуют предполагаемым ТопВ-рецепторам (МСА0440, МСА1957, МСА2074, МСА2180, МСА2321, МСА2751), одна или несколько могут быть специфическими для метанобактина. Кроме того, геном кодирует большое количество АВС-переносчиков (Ali et al., 2009).
Наконец, доказано, что метанобактин взаимодействует непосредственно с мММО. Добавление очищенного метанобактина из Мs. trichosporium ОВЗb к клеткам или мембранам Мс. capsulatus Bath, содержащим мММО, повышало активность фермента на ~ 35% (Graham, Kim, 2011). Предполагается возможная роль метанобактина в переносе электронов на медь в активном центре мрММО. В целом, метанобактин может участвовать в поглощении меди, защите от токсичности меди и, как следствие, от активных форм кислорода (АФК), в медь-зависимой регуляции двух ММО и каталитической активности мММО (Liu et al., 2011).
Date: 2015-09-24; view: 983; Нарушение авторских прав