
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Пути первичного метаболизма метанотрофов. Роль меди в окислении метана
|
|
Метанотрофы получают энергию в основном путем последовательного окисления метана до СО2 через ряд энзиматических превращений с образованием промежуточных продуктов: метанола, формальдегида и формиата (рис. 1). Как правило, 50% и более углерода метана окисляется до СО2, а остальное количество ассимилируется в клеточные метаболиты на уровне формальдегида.

Рис. 1. Пути окисления метана и С1 - ассимиляции у метанотрофов. Трансформация метана до СО2 представляет собой сложный комплекс ферментативных систем.
Метанотрофы реализуют 3 основные пути С1-ассимиляции - рибулозомонофосфатный цикл, сериновый путь и цикл Кальвина.
Рибулозомонофосфатный цикл. ВРМФ-пути является синтез триоз осуществляется из трех молекул формальдегида. 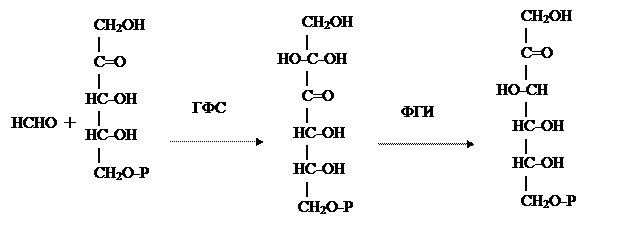 Ключевой реакцией РМФ-пути является катализируемая гексулозофосфатсинтазой (ГФС) альдольная конденсация формальдегида с рибулозо-5-фосфатом с образованием 3-гексулозо-6-фосфата, который далее под действием фосфогексулозоизомеразы (ФГИ) превращается во фруктозо-6-фосфат:
Ключевой реакцией РМФ-пути является катализируемая гексулозофосфатсинтазой (ГФС) альдольная конденсация формальдегида с рибулозо-5-фосфатом с образованием 3-гексулозо-6-фосфата, который далее под действием фосфогексулозоизомеразы (ФГИ) превращается во фруктозо-6-фосфат:
Рибулозо-5-фосфат 3-гексулозо-6-фосфат Фруктозо-6-фосфат
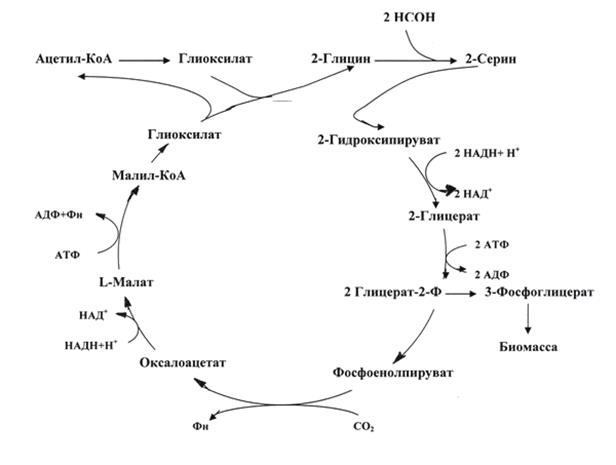
Сериновый цикл. Интермедиатами серинового цикла являются органические кислоты и аминокислоты (рис. 2). Этот цикл представляет собой цепь реакций, катализируемых сериноксиметилтрансферазой, серин-глиоксилатаминотрансферазой, оксипируватредуктазой, глицераткиназой и малил-КоА-лиазой. В итоге одна молекула фосфоглицерата синтезируется из двух молекул формальдегида и одной молекулы СО2.
РБФ-путь. Метилобактерии, реализующие этот путь, окисляют С1-субстраты последовательно до СО2, который фиксируется в реакции карбоксилирования рибулозо-1,5-бисфосфата с образованием 3-фосфоглицерата.Ключевым ферментом этого пути является рибулозобисфосфаткарбоксилаза (РБФК/О или Рубиско). РБФК/О может действовать и как оксигеназа, в этом случае образуются фосфоглицерат и фосфогликолат:
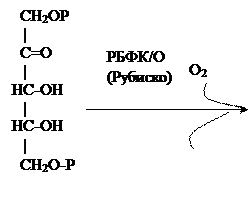 | |||
 | |||
|
Рибулозо-1,5-бисфосфат Фосфоглицерат Фосфогликолат
Окисление метана до метанола катализируют две формы метанмонооксигеназы (ММО): мембрансвязанная (мММО) и растворимая (рММО).
|

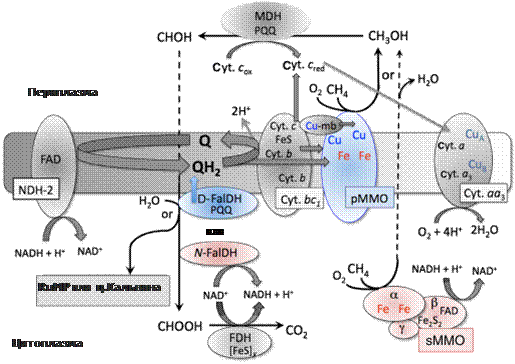
Рис. 3. Пути первичного метаболизма метанотрофных бактерий (Semrau et al., 2010). pММО (particulate methane monooxygenase) – мембрансвязанная метанмонооксигеназа; sММО – растворимая (soluble) метанмонооксигеназа; MDH – метанолдегидрогеназа; Cyt – цитохром; Q – убихинон; D-FalDH – хинон-связывающая формальдегиддегидрогеназа; N-FalDH – НАД(Ф)-зависимая формальдегиддегидрогеназа; FDH – формиатдегидрогеназа; NDH-2 – тип 2 НАДН-дегидрогеназы; FAD – флавинадениндинуклеотид; PQQ – пирролохинолинхинон; RuMP – рибулозомонофосфат.
мММО локализуется в цитоплазматических мембранах, главным образом ВЦМ, и обнаружена у большинства известных метанотрофов, за исключением представителей родов Methylocella и Methyloferula (Dedysh et al., 2000; 2004; 2005). Показано, что мММО составляет до 60-80% тотальных мембранных белков клеток (Nguyen et al., 1998; Murrell et al., 2000; Smith et al., 2002). рММО присутствует у некоторых метанотрофов и локализована в цитоплазме. У метанотрофов, имеющих оба фермента, медь является ключевым фактором в регуляции их активности и экспрессии генов, кодирующих эти ферменты (Murrell et al., 2000). Например, у Methylosinus trichosporium OB3B, выращенного на стандартной нитратной минеральной среде, активность рММО не обнаруживалась при избытке меди по отношению к биомассе – 45,64 ммоль Cu2+/г белка (Morton et al., 2000).
Гены, кодирующие мММО, организованы в оперон pmo CAB, где pmo B, pmo A и pmo C кодируют полипептиды субъединицa, b и g с предполагаемыми м.м. 46, 28 и 29 кДa, соответственно, которые включают сигнальные последовательности (Semrau et al., 1995). Анализ аминокислотных последовательностей выявил у a-пептида 3 трансмембранных домена, у b-пептида – 5, а у g-пептида - 6 (Cserzo et al., 1997).У Mc. capsulatus Bath, Ms. trichosporium OB3bи Methylocystis sp. M обнаружены две практически идентичные копии этого оперона (Semrau et al., 1995; Gilbert et al., 2000), а у Mc. capsulatus Bath - третья копия гена pmo C (Stolyar et al., 1999), нуклеотидная последовательность которой отличается от двух аналогичных генов, входящих в состав оперонов. Мутации по данным генам показали необходимость обоих оперонов для проявления максимальной активности мММО. Прослеживается аналогия дуплицирования оперона pmo CAB у метанотрофов и amo CAB нитрифицирующих бактерий, в геноме которых также найдены две копии генов, кодирующих аммониймонооксигеназу (АМО) (Holmes et al., 1995), и третья копия гена, аналогичного pmo C: amo C (Stein et al., 2000). Необходимо отметить, что АМО и мММО являются гомологами, поскольку АМО также способна окислять метан, но гораздо менее активно.
Соотношение субъединиц мММО и молекулярная структура нативного фермента интенсивно исследуются (Lieberman et al., 2003). Изначально предполагалось, что стехиометрическое соотношение пептидов α: β: γ мММО Mc. capsulatus Bath равно 1:1:1 и, соответственно, фермент представляет собой гетеротример ~100 кДа (Yu et al., 2003). Но с помощью нативного гель-электрофореза (BN-native) в присутствии неденатурирующих агентов (перфтороктановой кислоты и др.) показано, что м.м. мММО составляет 200 кДа и соответствует составу (αβγ)2. Тем не менее, возможны другие варианты, поскольку при нативном гель-электрофорезе выявляется дополнительная белковая полоса с м.м. ~ 440 кДа, что может соответствовать тетрамеру. У Ms. trichosporium OB3b м.м. фермента составляет 326 кДа, а у Ms. trichosporium IMV 3011 ~96 кДа (Takeguchi et al., 1998, 1999; Okura et al., 2000; Xin et al., 2002). Рентгеноструктурный анализ кристаллизованной мММО показал, что фермент является тримером (αβγ)3, где каждый мономер αβγ содержит один двухвалентный и два спинсвязанных атома меди (Lieberman et al., 2003).
Активная мММО содержит 2 атома железа и около 15 атомов меди на одну молекулу фермента. Физиологическими восстановителями для мММО являются цитохромы b 559/569 или c 553, искусственными – дурохинол и НАДН. Для проявления активности мММО необходимы молекулы небольшого флуоресцирующего хромопептида (1,2 кДа) – метанобактина, ответственного также за транспорт ионов меди и поддержание их уровня в клетках. мММО имеет высокое сродство к метану (K m 1-2 мкM) и кислороду (K m 0,1 мкM), но обладает узкой субстратной специфичностью, соокисляя лишь короткие алканы, алкены и метанол (Morton et al., 2000; Dalton, 2005).
Недавно у Methylocystis sp. SC2 обнаружены два изофермента, имеющих разные кинетические параметры окисления метана (Baani et al., 2008). При экспрессии гена pmoCAB1, кодирующего мММО1, фермент окисляет СН4 при >600 ppm. Напротив, конститутивно экспрессируемый ген pmoCAB2 кодирует мММО2 с K m = 0,11 мкМ, окисляющую следовые количества метана (10-100 ppm). Интересно, что большинство метанотрофов II типа обладают генами pmoCAB2, которые не были найдены у метанотрофов I типа (Yimga et al., 2003). Это объясняет доминирование II типа в автоморфных почвах и выживание за счет потребления атмосферного метана, благодаря наличию мММО с низким сродством (K mСН4 0,01-0,3 мкМ).
Предложено несколько гипотетических структур активного центра мММО, в состав которого входят ионы меди и железа (Lieberman, Rosenzweig, 2004). Согласно одной из гипотез, в молекуле фермента располагаются два Cu-связываюших участка: С и Е, при этом С-сайт функционирует как активный центр мММО, а Е-сайт является переносчиком электронов (Takeguchi et al., 1999). Данная гипотеза подтверждена в эксперименте с заменой ионов меди на ионы цинка в активном центре мММО (Chan et al., 2004). Донорами электронов для очищенной мММО служат аскорбат, дурохинон и метанол, но не НАД(Ф)Н. Примечательно, что мММО имеет высокое сродство к метану (Km=1-2μM) и кислороду (Km=0.1μM), но обладает узкой субстратной специфичностью, соокисляя лишь короткие алканы, алкены и метанол (Morton et al., 2000; Dalton, 2005).
рММО - цитоплазматический ферментный комплекс, состоящий из трех компонентов: гидроксилазы, редуктазы и регуляторного белка В, кодируемых генами, расположенными в одном опероне mmoXYBZDC. Гидроксилазный компонент - олигомер (250 кДа), состоящий из трех субъединиц: a2-двуядерного негемового железного центра (60 кДа), b2 (45 кДа) и g2 (20 кДа), кодируемых генами mmoX, mmoY и mmoZ, соответственно(Dalton, 2005). Редуктазный компонент (38.4 кДа) содержит ФАД и [Fe2S2]-кластер, кодируется геном mmoC. Редуктаза акцептирует электроны от НАДН и переносит их на двужелезный сайт гидроксилазы. Регуляторный компонент - 15,8 кДа белок B, кодируемый геном mmo B, не содержит простетической группы и кофактора, но связывается с гидроксилазным компонентом и необходим для эффективной работы рММО (Merkx et al., 2001; Smith et al., 2002). Функция белка mmoD неизвестна, но предполагается его участие в сборке активного сайта редуктазного компонента (Merkx and Lippard, 2002).
рММО соокисляет широкий спектр ароматических, гетероциклических, ациклических и галогенированных углеводородов (Grosse et al., 1999). Однако рММО имеет более низкое сродство к метану (Km=3μM) и кислороду (Km= 16.8 μM). Кроме того, pММО функционирует только при низких концентрациях меди в среде (<0.8μM), что делает затруднительным использование фермента в целях биоремедиации, так как редко встречаются загрязненные экосистемы с низким содержанием меди (Lieberman, Rosenzweig, 2004; Dalton, 2005).
У метанотрофов, обладающих обеими формами ММО, их экспрессия определяется наличием меди в среде культивирования и регулируется на уровне транскрипции (Gilbert et al., 2000; Morton et al ., 2000; Murrell et al., 2000a; 2000b). Причем экспрессия рММО происходит при низкой концентрации ионов меди < 0,8 µ M, тогда как при повышении концентрации меди до ≥ 4 µ M экспрессируется мММО и возрастает количество ВЦМ (Prior, Dalton, 1985). При анализе экспрессии белков у Mc. capsulatus Bath в ответ на повышение меди в среде впервые у прокариот обнаружен гемоэритрин, белок – переносчик кислорода у беспозвоночных (Kao et al., 2004; Karlsen et al., 2005). Гемоэритрин Mc. capsulatus Bath обладает характерными мотивами для связывания атомов железа и кислорода и, возможно, участвует в окислении метана, будучи донором атомов кислорода для мММО.
Анализ промоторной области выявил наличие двух предполагаемых σ54 и σ70 – зависимых промоторов, расположенных выше гена mmo X у Mc. capsulatus Bath и Ms. trichosporium OB3b. В дальнейшем был найден сайт связывания с белком-активатором (UAS) у данных метанотрофов, что указывает на его участие в образовании транскрипционно-компетентного открытого комплекса с σ54-зависимым промотором (Wösten, 1998). У Ms. trichosporium OB3b имеется дополнительный σ70-зависимый промотор между генами mmoX и mmoY, который также репрессируется ионами меди. Роль данного промотора предстоит выяснить (Nielsen et al., 1997). Предполагается, что транскрипция генов рММО с σ54-зависимого промотора подвержена позитивному контролю, а транскрипция оперона pmoCAB σ70 – зависимого промотора подвержена негативному контролю (Gilbert et al., 2000; Murrell et al., 2000), как показано на рисунке 4.
У Mc. capsulatus Bath обнаружены 4 новых гена(mmoG, mmoQ, mmoS и mmoR), которые расположены после оперона mmoXYBZDC и кодируют белки, участвующие в регуляции экспрессии рММО. Ген mmoG кодирует белок 59.5 кДа, похожий на шаперонин GroEL, и, возможно, участвует в сборке комплекса рММО или в инициации транскрипции оперона mmoXYBZDC. Гены mmoQ и mmoS кодируют белки предполагаемой двухкомпонентной сигнальной системы, в которой белок MmoS (128.6 кДа) играет роль сенсора, а MmoQ (69.8 кДа) – регулятора (Murrell et al., 2000).
 |
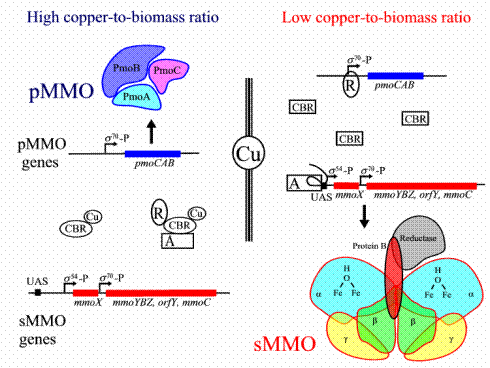
Рис. 4. Модель реципрокной регуляции транскрипции генов мММО и рММО у
Ms. trichosporium OB3b (Murrell et al., 2000). При высокой концентрации меди в среде предполагаемый репрессор (R) оперона pmoCAB связывается с Cu2+ – связывающим регулятором (CBR) и начинается транскрипция мММО. Комплекс CBR-Cu2+ также связывает предполагаемый активатор (A) транскрипции генов рММО. При низкой концентрации меди комплекс CBR-Cu2+ не образуется, поэтому репрессор R и
активатор A находятся в свободном состоянии, что приводит к транскрипции генов рММО и репрессии оперона pmoCAB.
MmoS не содержит специфических металл-связывающих мотивов, что исключает какое-либо прямое связывание с металлами, например, с ионами меди. Поэтому первичным сигналом может служить редокс-баланс окружающей среды, который от сенсора MmoS передается на регулятор MmoQ с помощью фосфорилирования. Далее, MmoG, вероятно, регулирует транскрипцию генов рММО посредством изменения конформации белка MmoR (63.4 кДа), активатора транскрипции с σ54-зависимого промотора, кодируемого соответствующим геном mmoR. Предполагается, что «активированный» таким образом белок MmoR может участвовать в сборке комплекса рММО (Csáki et al., 2003). Гены mmoG и mmoR были идентифицированы у Ms. trichosporium OB3b. В отличие от Mc. capsulatus Bath, они расположены выше генов рММО (Stafford et al., 2003).
Однако гены двухкомпонентной регуляторной системы (mmoQ и mmoS) не были обнаружены.
Анализ мутантов по генам mmoG и mmoR показал их необходимость в транскрипции генов рММО у Mc. capsulatus Bath и Ms. trichosporium OB3b (Csáki et al., 2003; Stafford et al., 2003). Мутация по гену rpoN у Ms. trichosporium OB3b, кодирующему σ54 фактор (σN), блокировала экспрессию рММО, что указывает на необходимость этого гена в транскрипции генов рММО (Stafford et al., 2003). Таким образом, идентификация новых белков и генов, участвующих в экспрессии мММО и рММО, указывает на сложную, но в то же время гибкую интегральную регуляцию экспрессии и активности ММО.
Date: 2015-09-24; view: 2001; Нарушение авторских прав