
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Монофункциональные соединения
|
|
Спирты
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3-СН2-ОН 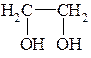
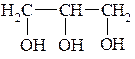
Этанол Этиленгликоль Глицерин
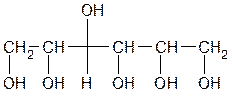
Сорбит
II. По характеру R различают: 1) предельные, 2) непредельные,
3) циклические, 4) ароматические.
2) СН2 = СН-СН2-ОН
Аллиловый спирт
 3) К непредельным циклическим спиртам относятся:
3) К непредельным циклическим спиртам относятся:
ретинол (витамин А) и холестерин

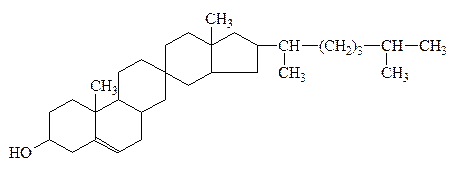 Инозит
Инозит
витаминоподобное в-во
группы В
|
| 4) |  Бензиловый спирт
Бензиловый спирт
|
III. По положению гр. –ОН различают первичные, вторичные и третичные спирты.
IV. По количеству атомов С различают низкомолекулярные и высокомолекулярные.
СН3–(СН2)14 –СН2–ОН (С16Н33ОН) СН3–(СН2)29 –СН2ОН (С31Н63ОН)
Цетиловый спирт Мирициловый спирт
Цетилпальмитат – основа спермацета, мирицилпальмитат содержится в пчелином воске.
Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта


 СН-кислотный Nu центр
СН-кислотный Nu центр
|
|
 | |||||
 |
| ||||
R ® СН2 ® О Н
 | |||
 | |||
Электрофильный Центр Кислотный
центр основности центр
Р-ции окисления
и Е
1) Спирты – слабые кислоты.
2) Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
3) –I эффект гр. –ОН увеличивает подвижность Н у соседнего углеродного атома. Углерод приобретает d+ (электрофильный центр, SЕ) и становится центром нуклеофильной атаки (Nu). Связь С–О рвется более легко, чем Н–О, поэтому характерными для спиртов явл-ся р-ции SN. Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает d+ атома углерода и облегчает разрыв связи. К этому типу относятся р-ции образования эфиров, галогенопроизводных.
4) Смещение элекронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут р-ции окисления и элиминирования (Е).
Физические св-ва
Низшие спирты (С1–С12) – жидкости, высшие – твердые вещ-ва. Многие св-ва спиртов объясняются образованием Н-связи:
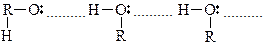
Date: 2015-09-24; view: 968; Нарушение авторских прав