
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Введение в титриметрический анализ. Метод нейтрализации
|
|
Введение в титриметрический анализ
Аналитическая химия – наука о методах определения качественного и количественного состава вещества или их смесей.
Качественный анализ позволяет определить, какие элементы, группы атомов, ионов, молекул, радикалов входят в состав анализируемого вещества или смеси веществ.
Количественный анализ позволяет установить количественные соотношения компонентов данного соединения или смеси веществ.
Исследуя новое соединение, прежде всего, устанавливают, из каких компонентов оно состоит, а затем находят их количественные соотношения. Поэтому качественный анализ вещества предшествует количественному. Если качественный состав анализируемого материала известен, то приступают к количественному анализу, выбрав наиболее подходящий метод.
В настоящее время аналитическая химия пользуется многочисленными и разнообразными методами, которые подразделяют на физические, физико-химические и химические. Химические методы, в свою очередь, включают гравиметрию (весовой анализ) и титриметрию (объемный анализ). Преимущество титриметрического анализа перед гравиметрическим состоит в быстроте определений.
В клинических лабораториях и лабораториях промсанхимии широкое распространение получил титриметрический анализ, так как для его проведения требуется простейшее лабораторное оборудование, не значительные затраты труда и времени, достаточно большая универсальность и высокая точность.
Титриметрический анализ основан на измерении объема титранта (раствора точно известной концентрации), израсходованного на реакцию с определяемым веществом, при этом вещества должны реагировать в строго эквивалентных количествах.
Процесс постепенного добавления титранта к анализируемому веществу называется титрованием, а момент завершения реакции – моментом эквивалентности.
Титриметрическое определение вещества сводится к проведению химической реакции смешиванием растворов двух реагирующих веществ. Эта операция проводится титрованием – добавлением небольших порций раствора одного из веществ к известному объему раствора второго вещества.
Один из двух растворов содержит вещество с неизвестной концентрацией и представляет собой анализируемый раствор. Второй раствор содержит реагент с точно известной концентрацией и называется рабочим раствором или титрантом.
Для проведения титриметрического анализа необходимо:
1) знать точную концентрацию титранта;
2) точно измерить объемы растворов титранта и исследуемого вещества;
3) точно фиксировать момент эквивалентности.
Для точного измерения объемов растворов реагирующих веществ используют мерную посуду – бюретки, пипетки, мерные колбы и пр.
В процессе титрования достигается точка эквивалентности (момент эквивалентности), т. е. момент, когда количество вещества эквивалента в добавленном растворе титранта становиться равным количеству анализируемого вещества.
Химические вещества реагируют между собой в определенных количественных соотношениях. Уравнение реакции показывает минимальные целочисленные количества химических веществ, вступающих в реакцию, а так же образующихся в результате реакции. В общем случае эти количества различны. Однако для удобства расчетов в химии используют особое понятие – химический эквивалент вещества, дающее возможность выразить количества реагирующих и образующихся веществ одинаковыми числами.
Из самого определения понятия химического эквивалента вытекает, что в химической реакции обязательно участвует равное число эквивалентов двух веществ (кислоты и основания, окислителя и восстановителя и т. д.).
Равными оказываются и количества вещества эквивалента тех же веществ:
n(1/zT) = n(1/zХ)
это равенство представляет собой математическое выражение закона эквивалентов. Выразим количество вещества эквивалента через концентрацию и объем раствора:
n(1/zХ) = С(1/zХ) · Vх
n(1/zT) = С(1/zT) · Vт
С(1/zТ) – молярная концентрация эквивалента титранта, моль/дм3
V(Т) – объем титранта, см3
С(1/zХ) – молярная концентрация эквивалента исследуемого вещества, моль/дм3
V(Х) – объем раствора исследуемого вещества, см3
(1/zT) ∙ V(T) = C(1/zX) ∙ V(X)
Таким образом, в момент эквивалентности число эквивалентов титранта и анализируемого вещества равны.
По достижении точки эквивалентности титрование обычно заканчивают и отмечают затраченный объем раствора. Следовательно, при выполнении титриметрического анализа необходимо располагать методом определения момента эквивалентности. Для этого используют свойства растворов, которые резко меняются в точке эквивалентности.
Момент эквивалентности определяют:
1) с помощью индикаторов;
2) по изменению окраски раствора одного из реагирующих веществ;
3) по прекращению выпадения осадка или изменению цвета осадка;
4) с помощью приборов, например, потенциометров, кондуктометров и пр.
Зная точную концентрацию титранта С(1/zТ), объем исследуемого раствора и объем раствора титранта V(Т) в момент эквивалентности, можно легко рассчитать концентрацию раствора исследуемого вещества С(1/zХ):
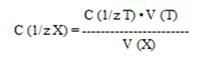
Из выше указанного уравнения можно определить титр раствора исследуемого вещества t(Х):

В титриметрическом анализе могут использоваться не все химические реакции, а только те, которые отвечают определенным требованиям:
1) реакция должна быть практически необратимой;
2) реакция должна протекать быстро, в строгом соответствии с законом эквивалентов, без побочных процессов;
3) необходимо точно фиксировать момент эквивалентности.
Разнообразные методы титриметрического анализа можно классифицировать в зависимости от характера химической реакции, лежащей в их основе, и по способу проведения анализа.
Используют следующие основные типы химических реакций:
Ø Кислотно-основное титрование — основано на взаимодействии кислот и оснований.
Ø Оксидиметрия — основана на протекании окислительно-восстановительных реакций.
Ø Осадительное титрование — основано на образовании осадков.
Ø Комплексонометрия — основана на реакциях комплексообразования.
Сущность кислотно-основного титрования (метод нейтрализации)
В основе кислотно-основного титрования лежит соединение ионов Н3О+ и гидроксид-ионов ОН – с образованием малодиссоциирующих молекул воды. В упрощенном виде
Н+ + ОН– = Н2О
Метод позволяет определять в растворах не только концентрацию кислот или оснований, но также и концентрацию гидролизующихся солей.
Для определения в растворах концентрации оснований или солей, дающих при протолизе щелочную реакцию, используют в качестве титранта растворы кислот. Эти определения называют ацидиметрией (от лат. аcidum — кислота).
Концентрацию кислот и гидролитически кислых солей определяют с помощью титрантов растворов сильных оснований. Такие определения называют алкалиметрией (от лат. alkali – щелочь).
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, например изменением окраски раствора, точку эквивалентности определяют с помощью индикаторов.
Согласно ионной теории индикаторов Оствальда (1894г.), индикаторы в методе кислотно-основного титрования представляют собой такие слабые органические кислоты или основания, у которых недиссоциированные молекулы и ионы имеют различную окраску.
Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами и обозначают через IndOH, где Ind+ - катион индикатора. Такие индикаторы диссоциируют по схеме:
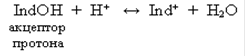
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают через HInd. Молекула такого индикатора играет роль донора протона, т. е. дает при диссоциации катион Н+ и анион Ind–:
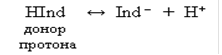
Все индикаторы изменяют свою окраску плавно в определенном интервале значений рН, называемом интервалом перехода, или зоной перехода окраски индикатора. Внутри зоны перехода имеется такое значение рН, при котором индикатор наиболее резко изменяет свою окраску. В этот момент концентрации молекулярной и ионной форм индикатора равны [HInd] = [Ind–]. Значение рН, при котором индикатор наиболее резко меняет свою окраску, называется показателем титрования (рТ).
В табл. 1 указаны область перехода, показатель титрования, окраска недиссоциированных молекул и анионов некоторых индикаторов.
Таблица1
Характеристики некоторых индикаторов
| индикатор | область перехода рН | показатель титрования рТ | окраска недиссоциированных молекул | окраска анионов |
| метилоранж | 3,1 — 4,0 | 4,0 | красная | оранжево-желтая |
| метилрот | 4,2 — 6,2 | 5,5 | красная | желтая |
| лакмус | 5,0 — 8,0 | 7,0 | красная | синяя |
| фенолфталеин | 8,0 — 10,0 | 9,0 | бесцветная | малиновая |
Если упрощенно обозначить молекулы фенолфталеина через HInd, а анионы его через Ind–, то уравнение диссоциации будет иметь вид
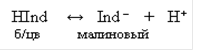
Достаточно к раствору, содержащему фенолфталеин, прибавить немного щелочи, как введенные ионы ОН– станут связывать протоны с образованием малодиссоциирующих молекул воды. При этом равновесие диссоциации индикатора сместится вправо и накопление анионов Ind– вызовет окрашивание раствора в малиновый цвет.
Наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то повышение концентрации протонов будет подавлять диссоциацию молекул индикатора. Равновесие сместится влево и раствор обесцветится. Аналогичным образом объясняют поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы в синий; нейтральные растворы лакмуса имеют промежуточную фиолетовую окраску. Это подтверждает, что цвет водного раствора индикатора зависит от соотношения между его молекулярной и ионной формами.
Таким образом, окраска молекул индикаторов, обладающих кислотными свойствами, проявляется в кислой среде, а окраска аниона — в щелочной.
В каждом конкретном случае кислотно-основного титрования индикатор подбирается таким образом, чтобы показатель титрования его как можно точнее совпадал с истинным моментом эквивалентности.
На правильный выбор индикатора влияет гидролиз солей, образующихся в процессе титрования. Различают четыре случая выбора индикаторов.
1. Титрование сильного основания сильной кислотой (или наоборот)
Например: HCl + NaOH = NaCl + H2O
Соли катионов сильных оснований и анионов сильных кислот гидролизу не подвергаются, рН раствора 7, поэтому и момент эквивалентности будет при рН = 7. Для фиксирования момента эквивалентности в этом случае применяются любые индикаторы с рТ = 7 (например, лакмус и др.)
2. Титрование сильной кислотой слабого основания
Например: HCl + NH4OH = NH4Cl + H2O
Образующаяся соль подвергается гидролизу: NH4+ + H2O ↔ NH4OH + H+
Среда раствора кислая, рН < 7, поэтому и момент эквивалентности будет при рН < 7. Для фиксирования момента эквивалентности применимы любые индикаторы с рТ < 7 (например, метилоранж, метилрот и др.).
3. Титрование слабой кислоты сильным основанием
Например: CH3COOH + NaOH = CH3COONa + H2O
Образующаяся соль подвергается гидролизу: СН3СОО – + Н2О ↔ CH3COOН + OН –
Среда щелочная, рН > 7, поэтому и момент эквивалентности будет при рН > 7. Для фиксирования момента эквивалентности применимы любые индикаторы с рТ > 7 (например, фенолфталеин и др.).
4. Титрование слабой кислоты слабым основанием (или наоборот)
Например: NH4OH + CH3COOH = CH3COONН4 + H2O
Такое титрование практически не применяется, т.к. соли катионов слабых оснований и анионов слабых кислот в растворах легко гидролизуются:
NH4+ + СН3СОО– + Н2О ↔ NH4OH + CH3COOН
В результате гидролиза образуются слабые электролиты, среда раствора остается практически нейтральной, рН = 7. Так как концентрации ионов Н+ и ОН– в растворе меняются незначительно, то они не оказывают существенного влияния на смещение индикаторного равновесия. В этом случае индикаторы свою окраску не изменяют, следовательно, слабые кислоты слабыми основаниями (или наоборот) точно не титруются.
Более точно выбор индикаторов проводят по кривым титрования.
Кислотно-основное титрование применяется в клинических лабораториях при определении кислотности желудочного сока, буферной емкости крови, спинномозговой жидкости и пр., что используется при постановке диагноза и лечении больных.
С помощью этого метода анализируются лекарственные вещества, устанавливается доброкачественность пищевых продуктов (молока, хлеба, муки и др.). Большое значение метод нейтрализации имеет при санитарно-гигиенической оценке состояния окружающей среды (природных водоемов, почвы, промышленных стоков и др.).
Контрольные вопросы
1. Принципы титриметрического анализа.
2. Классификация методов титриметрического анализа.
3. Титрование, требования к реакциям объемного анализа.
4. Момент эквивалентности реакции, методы фиксирования момента эквивалентности.
5. Закон эквивалентов, количественные расчеты в объемном анализе.
6. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
7. Индикаторы метода нейтрализации. Ионная теория индикаторов Оствальда.
8. Зона перехода окраски индикатора. Показатель титрования, его значение.
Date: 2015-09-22; view: 1395; Нарушение авторских прав