
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Растворы. Способы выражения концентрации растворов
|
|
Учение о растворах представляет для медиков особый интерес, поскольку растворы имеют большое значение в биологии, физиологии, медицине и фармации. Растворами являются биологические жидкости организма: кровь, лимфа, спинномозговая и другие жидкости. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Лекарственные вещества эффективны лишь в растворенном состоянии или переходят в растворенное состояние в организме.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более компонентов. Каждый из компонентов раствора равномерно распределён между другими по всему объёму раствора в виде молекул, атомов или ионов.
По агрегатному состоянию растворы могут быть газообразными, жидкими и твёрдыми. Компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считается растворителем, остальные составляющие раствора – растворёнными веществами. Если все компоненты раствора находятся в одном агрегатном состоянии, растворителем считается тот из них, которого в растворе больше.
Важная характеристика раствора – концентрация. Она выражает относительное содержание растворённого вещества в растворителе. Этой величиной определяются многие свойства растворов.
В связи с введением в действие СИ, применяются следующие способы выражения концентрации растворов.
Массовая доля растворённого вещества – отношение массы растворённого вещества к массе раствора.
Wв = mв / mр
Wв – массовая доля растворённого вещества;
mв – масса растворённого вещества (г, кг);
mр– масса раствора (г, кг).
Массовую долю растворенного вещества (Wв) обычно выражают в долях единицы или %-ах.
Например, массовая доля растворённого вещества гидроксида натрия NaOH в воде = 0,1 или 10%. Это означает, что в растворе массой 100 г содержится NaOH массой 10 г и вода массой 90 г.
Молярная концентрация – показывает число молей растворенного вещества в одном кубическом дециметре раствора.
С(х) = n(х) / V,[моль/дм3, моль/л, М]
С(х) – молярная концентрация вещества;
n(х) – число моль вещества;
V – объём раствора (дм3, л).
Например, С(NaOH) = 0,1 моль/дм3;
С(H2SO4) = 0,5 моль/дм3;
С(Н+) = 2 ∙10 –2 моль/дм3.
Молярное соотношение реагирующих веществ не всегда равно 1÷1, оно определяется стехиометрическими коэффициентами в уравнении реакции. В связи с этим вводится понятие «химический эквивалент».
Химический эквивалент – реальная или условная частица вещества, которая в обменной реакции эквивалентна одному протону, а в о/в реакции – одному электрону.
В связи с этим понятием вводится ещё один способ выражения концентрации растворов – молярная концентрация эквивалента вещества.
Молярная концентрация эквивалента вещества (нормальная концентрация) – показывает число моль эквивалента вещества в одном дм3 (л) раствора.
Молярную концентрацию эквивалента вещества обозначают С(1/zX) выражают [моль/дм3, моль/л, н].
Выражение 1/z называется фактором эквивалентности. Он показывает, какая доля реальной частицы вещества соответствует эквиваленту.
В обменных реакциях число z показывает суммарный заряд обменивающихся ионов (в соответствии с уравнением реакции, знак заряда во внимание не принимается), в о/в реакциях – число отданных или принятых электронов.
Важно отметить, что одно и то же вещество может иметь разные эквиваленты в разных химических реакциях, поэтому эквивалент вещества может быть определён только для конкретной реакции. Рассмотрим это на примерах:
1. В реакциях обмена с участием Н2SO4 может происходить замещение одного или двух протонов. В зависимости от этого эквивалент серной кислоты меняется:
а) H2SO4 + NaOH = NaHSO4 + H2O z = 1 => 1/z = 1
б) H2SO4 + 2NaOH = Na2SO4 +2 H2O z = 2 => 1/z = 2
2. В о/в реакциях с участием КМnO4 в зависимости от кислотности среды образуются продукты восстановления, число электронов меняется, поэтому и эквивалент КМnO4 также будет разным:
а) кислая среда
МnO4– + 8Н+ + 5 е → Mn2+ + 4H2O z = 5 => 1/z = 1/5
б) нейтральная среда
МnO4– + 3Н+ + 3 е → MnО2 + 2H2O z = 3 => 1/z= 1/3
в) щелочная среда
МnO4 – + 1 е → MnО42– z = 1 => 1/z = 1
Необходимо быстро и правильно переходить от одного способа выражения концентрации к другому. Полезно запомнить, что С(1/zХ) = z ∙ С(Х)
Если 1/z = 1, то молярная концентрация эквивалента вещества будет равна молярной концентрации. Во всех других случаях она всегда будет больше молярной концентрации во столько раз, во сколько раз эквивалент меньше реальной частицы, т.е.
С(1/zХ): С(Х) = z
Например, молярная концентрация эквивалента раствора Н3РО4 с молярной концентрацией С(Н3РО4) = 0,2 моль/дм3 составляет С(1/3 Н3РО4) = 0,2 · 3 = 0,6 моль/дм3.
Расчёт молярных масс эквивалентов М (1/z Х) кислот, щелочей солей,
окислителей-восстановителей
Молярная масса эквивалента кислоты есть отношение молярной массы данной кислоты к числу ионов водорода участвующих в реакции:
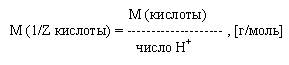
Молярная масса эквивалента основания есть отношение молярной массы основания к числу ионов гидроксила участвующих в реакции:
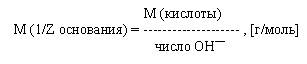
Молярная масса эквивалента соли есть отношение молярной массы соли к произведению числа атомов металла данной соли на его степень окисления.
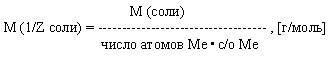
Молярная масса эквивалента окислителя или восстановителя есть отношение молярной массы окислителя или восстановителя к числу электронов, отданных или принятых в данной реакции.
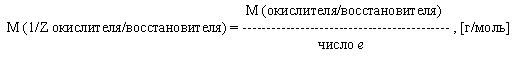
Титр – отношение массы растворённого вещества к объёму раствора.
t = m / V, [г/см3]
t – титр раствора;
m – масса растворённого вещества, г;
V – объём раствора.
Например, t(Na2СО3) = 0,00125 г/см3, означает, что в 1см3 раствора содержится 0,00125 г Na2СО3.
Для освоения темы «Способы выражения концентрации растворов» необходимо знать следующие понятия и их обозначения:
mв – масса растворённого вещества (г, кг);
mр – масса раствора (г, кг);
Wв – массовая доля вещества (доля единицы, %);
М(Х) – молярная масса вещества (г/моль, кг/моль);
1/z – фактор эквивалентности (безразмерная величина);
n(Х) – количество вещества (моль);
n(1/zХ) – количество вещества эквивалента (моль);
С(Х) – молярная концентрация (моль/дм3, моль/л);
С(1/zХ) – молярная концентрация эквивалента (моль/дм3, моль/л);
ρ – плотность раствора (г/см3, кг/м);
V – объём раствора (дм3, см3, м);
t – титр раствора (г/см3).
При решении задач полезно пользоваться формулами, вышеприведёнными, а также:
mр = ρр ∙ Vр;
n(Х) = m(Х) / М(Х);
m(Х) = С(Х) · М(Х) · V;
m(Х) = С(1/zХ) · М(1/zХ) · V.
Контрольные вопросы
- Растворы: значение и применение.
- Понятие эквивалента. Фактор эквивалентности.
- Расчет молярной массы эквивалента соединений.
- Способы выражения концентрации раствора:
Ø массовая доля растворенного вещества в растворе;
Ø молярная концентрация растворенного вещества в растворе;
Ø молярная концентрация эквивалента вещества в растворе;
Ø титр раствора.
Date: 2015-09-22; view: 930; Нарушение авторских прав