
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 4. НЕПРОХОДИМОСТЬ ЖЕЛЧНЫХ ПРОТОКОВ ДОБРОКАЧЕСТВЕННОЙ ЭТИОЛОГИИ 10 page
|
|
Этиология и патогенез. Наиболее частой причиной развития Рубцовых стриктур желчных протоков является их травматическое повреждение. Главным образом оно возникает после хирургических вмешательств на органах брюшной полости (холецистэктомии, резекции желудка) и крайне редко (у 1 % больных, по данным Г. Н. Цыбуляк, 1985) — при проникающих ранениях или тупой травме живота. В среднем, по данным многих хирургов, на 400—500 холецистэктомий приходится 1 повреждение желчного протока.
По данным нашей клиники, наиболее часто повреждения магистральных желчных протоков, которые впоследствии привели к Рубцовым сужениям, возникали во время холецистэктомий (85,1 %) и составляли при остром холецистите 31,5 %, хроническом — 53,6 %. После операций на желудке (чаще резекции) они развивались у 9,1 % больных, в результате воспалительного процесса и механических воздействий — у 4,3%. Рубцовые стриктуры желчных протоков могут возникать также после холедохото-мии, выполненной без показаний, особенно при диаметре желчного протока не более 10 мм, при неправильно выбранном направлении или слишком большой длине разреза, при разрыве стенки протока в результате грубого нарушения техники интраопераци-онной холангиоскопии и зондирования, а также при попытках насильственного удаления дренажей, фиксированных к стенкам протока нерассасывающимся шовным материалом, склерозировании клетчатки печеночно-дуоденальной связки при просачивании в нее желчи после холецистэктомий.
Среди общих причин интраоперационных повреждений желчных протоков McAllister и соавторы (1976), Burlui и соавторы (1982) О. Ю. Кушниренко и Г. Н. Суетин (1985) выделяют четыре основные: неадекватные условия операции, анатомические
вариации сосудов и протоков, плохо контролируемое кровотечение, невозможность идентификации тканевых структур в результате активного воспалительного процесса. Под условиями операции авторы подразумевают глубину наркоза и мышечную релаксацию, удобный доступ, достаточное освещение, проведение интраопера-ционной холангиографии.
Таким образом, наиболее частой причиной образования Рубцовых стриктур желчных протоков является ятрогенное повреждение их во время различных вмешательств на органах брюшной полости (по нашим данным, 97,4 %, по данным Э. И. Гальперина и соавторов (1982) и Littman (1982),—90— 99 %).
Характер повреждений желчных протоков во время операций на органах брюшной полости может быть различным. Иногда это захват протока в лигатуру при выполнении холецистэктомии (рис. 79, а), пересечение и перевязка протока при ошибочной идентификации элементов печеночно-дуоденальной связки (рис. 79, б).
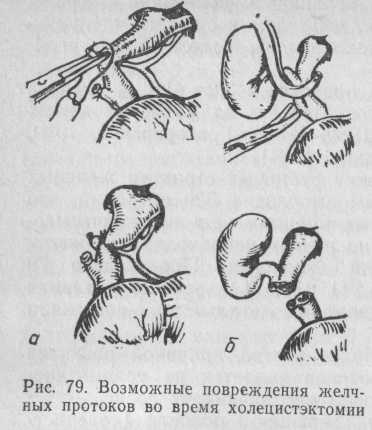
Желчный проток может быть травмирован во время операции на желудке (резекции, гастрэктомии, дренирующих операций после ваготомии). Риск таких осложнений особенно велик при пенетрации язвы в печеночно-дуоденальную связку, инфильтрации связки, низком расположении язвы в двенадцатиперстной кишке, когда ушивание культи производится атипично. При закрытой и открытой травмах живота среди повреждений органов брюшной полости повреждения внепеченочных желчных протоков составляют 2,2 % (Fartmann, Kirchner, 1982).
Под нашим наблюдением находились 4 (1,5%) больных, у которых образование рубцовой стриктуры желчных протоков можно было связать с травматическим повреждением, вызванным закрытой травмой живота. Подобные повреждения желчных протоков встречаются в 0,7—1 % случаев (Г. Н. Цыбуляк, 1985; Д. В. Усов, И. В. Литвиненко, 1985; Cavaliere и соавт., 1987, и др.).
Факторы, определяющие интенсивность и сроки эпителизации и образования соединительнотканного каркаса поврежденных участков стенки протока, еще недостаточно изучены. Экспериментальные исследования, проведенные Э. И. Гальпериным и соавторами (1980), показали, что при пластическом замещении желчных протоков васкуляризированным аутовенозным трансплантатом эндотелий на участке пересадки не образуется даже через 2 года после операции. Эпителизация по линии билиодигестивного анастомоза отмечена только через 1,5—2 года после операции (Э. И. Гальперин, Н. Ф. Кузовлев, 1978). Развитие соединительной ткани на месте повреждения желчного протока происходит путем формирования грубого рубца, резко деформирующего просвет протока.
Считают, что рубцовая стриктура желчных протоков развивается в результате задержки процессов созревания соединительной ткани, а последнее происходит вследствие постоянного действия желчи и инфекции (Э. И. Гальперин и соавт., 1982).
Следствием рубцового сужения желчного протока является нарушение желчеоттока. Именно с этим обстоятельством связывают наступающие в дальнейшем патологические изменения — холан-гит, холелитиаз, печеночную недостаточность. Вопрос о том, какая степень сужения желчных протоков вызывает существенное нарушение оттока желчи, изучен недостаточно. Ясно одно — чем уже проток, тем выраженней признаки холангита, тем быстрее развиваются холелитиаз и билиарный цирроз печени.
Длительность течения заболевания зависит от степени сужения желчных протоков, компенсаторных возможностей организма, а также от проводимого лечения. Нелеченый гнойный холангит уже через 1—3 мес приводит к возникновению множественных холангиогенных абсцессов печени. Сроки формирования билиар-ного цирроза печени колеблются в пределах 1 года — 2 лет, если сужение протоков осложнилось желтухой, а хирургическая коррекция не адекватна или не проводилась вовсе.
Холангит протекает более бурно, если сужение развилось на фоне уже созданного билиодигестивного анастомоза. Причинами этого служат рефлюкс кишечного содержимого в протоке, инфицирование желчи и раздражение слизистой оболочки желчных протоков кишечным соком.
Патологическая анатомия. Рубцовое сужение желчных протоков представлено утолщением и уплотнением стенки протока на ограниченном участке. Обычно идентификация такого участка не вызывает затруднений. Однако иногда, чтобы отличить доброкачественное сужение от злокачественного новообразования, приходится прибегать к гистологическому исследованию.
При изучении стриктур нужно обращать внимание на распространенность суженного участка, его диаметр, а также локализацию его по отношению к различным отделам желчных протоков. При степени сужения протока более 1/3 его диаметра возникают клинические проявления холестаза. Сужение протока на 2/3 его диаметра позволяет еще выполнить более простую пластическую операцию и восстановить проходимость протока. Сужение протока более чем на 2/3 его диаметра уже резко затрудняет выполнение восстановительных операций, а если протяженность поражения достигает 3 см и более, восстановительные операции становятся нерациональными. Поэтому целесообразно различать повреждения и сужения желчных протоков, захватывающие менее1/3 и более 2/3 диаметра.
Гистологические изменения на участке стриктуры характеризуются отсутствием эпителия и гиперплазией соединительной ткани с большим количеством коллагеновых волокон.
Изменения в печени зависят от степени нарушения желчеотто-ка и представлены холангиогенным гепатитом в различных стадиях развития, вплоть до билиарного цирроза печени.
Клиника и диагностика. Первичные повреждения желчных протоков во время операции проявляются обильным желчеистечением в месте травмы, а при полном пересечении становится видным просвет протока. Опытный хирург непременно заметит это осложнение. В тех случаях, когда нарушение целости стенки остается незамеченным или недостаточно тщательно произведено устранение повреждения, развивается перитонит или в послеоперационный период формируется наружный желчный свищ. Если пересеченный проток перевязывают, как, например, культю пузырного протока, в послеоперационный период сразу развивается интенсивная желтуха, которую не следует рассматривать как гепатит.
Повреждение желчных протоков вследствие закрытой травмы или ранения живота характерных клинических проявлений не имеет, а выявляется во время операции, предпринятой по поводу перитонита или в ходе обработки и ревизии раны.
Сформировавшиеся рубцовые стриктуры желчных протоков проявляются желтухой и холангитом. Быстрота появления и интенсивность желтухи прямо пропорциональны степени нарушения желчеоттока. Стриктура, занимающая 1/3 диаметра желчного протока, вызывает желтуху через несколько месяцев, когда присоединяется гнойный холангит, а в застойной желчи образуются хлопья и камни. Одновременно с иктеричностью кожи и склер появляются и другие признаки обтурационной желтухи — темная моча, обесцвеченный кал. Холангит проявляется ознобами с повышением температуры тела до 39—40 °С. В промежутках между приступами температура тела может быть нормальной или субфебрильной.
Непрерывное нарастание желтухи и холангита отмечается только при полной закупорке желчных протоков. В остальных случаях течение болезни приобретает волнообразный характер — периоды обострения чередуются с периодами купирования всех клинических проявлений. Однако благополучие при этом мнимое — холангит продолжает существовать, а поэтому неизбежно возникает рецидив.
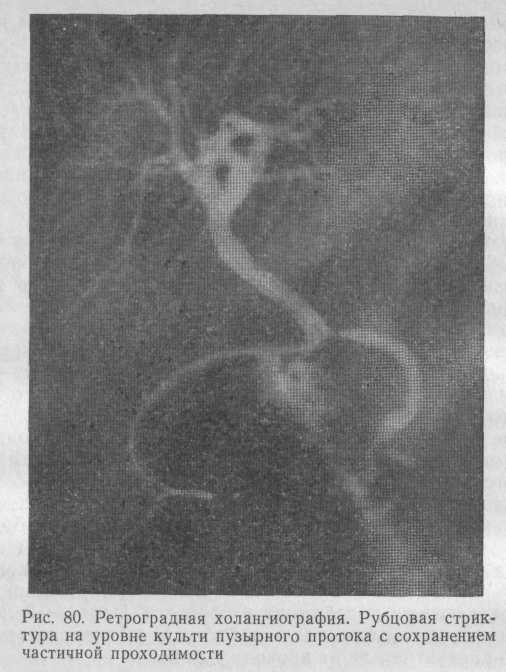
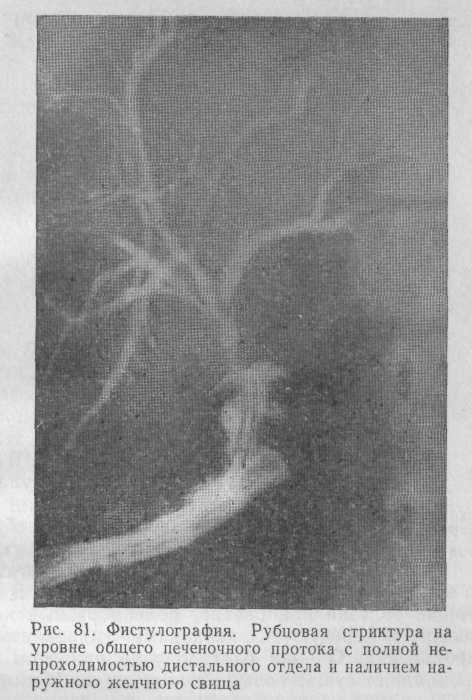
Диагностика рубцовых стриктур желчных протоков обычно не вызывает затруднений: операция в прошлом, перемежающаяся желтуха с постепенным переходом в стойкую, ознобы с повышением температуры тела до 39—40 °С, в ряде случаев наличие наружного желчного свища, спонтанное закрытие которого быстро ведет к прогрессированию желтухи. Обязательными являются ретроградная холангиография (рис. 80) и фистулография (рис. 81), позволяющие определить степень поражения желчных протоков и уровень непроходимости.
Однако иногда выполнение ретроградной холангиографии невозможно по техническим причинам (резекция желудка по способу Бильрот-П, анатомические особенности расположения большого сосочка двенадцатиперстной кишки или его дряблость в связи с отсутствием функции и др.), не всегда имеется желчный свищ. Во всех этих случаях можно воспользоваться чрескожной чреспеченочной холангиографией (рис. 82).

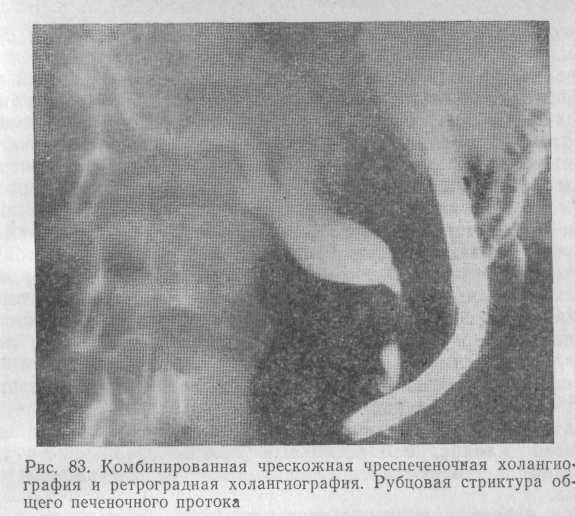
Перечисленные методы исследования дают лишь одностороннее представление о непроходимости желчных протоков, но не позволяют определить степень поражения протоков рубцовым процессом. Только при одновременном выполнении фистулографии или чрескожной чреспеченочной холангиографии и эндоскопической ретроградной холангиографии, когда контрастируются оба конца желчных протоков, картина рубцового поражения становится более ясной (рис. 83).
Но, к сожалению, все эти исследования, кроме фистулографии, можно выполнить лишь при наличии определенной аппаратуры и специалистов высокой квалификации, поэтому нередко в дооперационный период ограничиваются лишь клиническим представлением о диагнозе.
Классификация. Из множества предложенных классификаций Рубцовых стриктур желчных протоков наиболее удачна классификация Э. И. Гальперина и соавторов (1982), но излишняя детализация усложняет ее практическое использование.
Мы пользуемся классификацией А. А. Шалимова (1975), в которой рубцовые стриктуры желчных протоков различаются по характеру поражения: низкие, средние, высокие и по характеру оперативного лечения: 1) рубцовые стриктуры, требующие применения восстановительных операций; 2) рубцовые стриктуры, при которых необходимо выполнение реконструктивных операций.
К низким мы относим стриктуры, располагающиеся в супра-дуоденальной части общего желчного протока, к средним — стриктуры, захватывающие область гепатикохоледоха на 0,5—1 см выше края двенадцатиперстной кишки и на 0,5 см ниже места слияния долевых печеночных протоков (зона ворот печени), к высоким— все поражения общего печеночного протока, располагающиеся на расстоянии 0,5 см от места слияния долевых протоков и выше с переходом на последние. Все операции, выполненные на различном уровне поражения желчных протоков, делят на восстановительные и реконструктивные. Под первыми мы подразумеваем пластические операции, направленные на замещение дефектов при пристеночных поражениях, и операции создания прямых билиоби-лиарных анастомозов по типу «конец в конец» после циркулярного иссечения Рубцовых тканей. Эти операции предусматривают восстановление непрерывности протока и нормального оттока желчи в двенадцатиперстную кишку с сохранением запирательного механизма сфинктера печеночно-поджелудочной ампулы. Под вторыми мы подразумеваем операции, предусматривающие создание анастомоза между культей протока и каким-либо отделом пищеварительного канала. Все остальные методы оперативного лечения стриктур являются модификациями одного из этих двух способов.
Такая классификация отвечает принципам хирургической коррекции и последующей реабилитации больных с рубцовыми стриктурами желчных протоков.
Мы специально не выделяем группы больных с желтухой, хо-лангитом, циррозом печени, так как считаем, что у каждого больного с рубцовой стриктурой желчных протоков имеются признаки этих состояний. Это тяжелобольные с высоким риском оперативного вмешательства. Явления печеночной недостаточности, которые часто наблюдаются у таких больных, должны быть по возможности устранены в дооперационный период.
Лечение. Единственным методом лечения Рубцовых стриктур желчных протоков является своевременная и полноценная хирургическая коррекция. Консервативная терапия может проводиться лишь как подготовительный этап к оперативному лечению. Главным образом это относится к больным с явлениями печеночно-по-чечной недостаточности. X. X. Мансуров (1972) выделяет следующие формы ее: А — печеночная недостаточность преимущественно с явлениями экскреторных нарушений (повышение содержания билирубина, холестерина и щелочной фосфатазы в крови); Б — печеночная недостаточность преимущественно с васкулярными нарушениями (портальная гипертензия); В — печеночная недостаточность преимущественно с нарушениями на уровне гепатоцитов (изменение белковосинтезирующей функции печени, геморрагический диатез, коматозное состояние); Г — смешанные проявления недостаточности печени (А + Б, А + В, Б + В).
Больных с явлениями печеночной недостаточности переводят на диету, которая включает 20 % белков, 75 % углеводов и 5 % жиров и содержит 8374—12 560 кДж в сутки. Для восполнения запасов гликогена в печени ежедневно внутривенно вводят до 100 г глюкозы с соответствующим количеством инсулина (1 ЕД на 4 г глюкозы). Своевременное восполнение запасов гликогена уменьшает интоксикацию, повышает устойчивость печени к операционной травме, гипоксии, ацидозу. При наличии асцита прием натрия хлорида ограничивают до 0,5 г в сутки, так как вследствие гиперальдосте-ронизма происходит повышенная реабсорбция натрия в дисталь-ных канальцах почек.
Наиболее часто печеночная недостаточность сопровождается гипоксией смешанного типа, включающей элементы гипоксической, циркуляторной, гемической и гистотоксической гипоксии. Соответственно этому применяют патогенетически обоснованные меры лечения.
Для устранения гипоксической гипоксии производят коррекцию гипопротеинемии, вследствие чего уменьшается интерстициальный отек и улучшаются условия для альвеолярно-капиллярной диффузии.
По данным реогепатографии, полученным в нашей клинике (А. Е. Дубицкий, 1986), быстро развивающаяся обтурационная желтуха сопровождается уменьшением притока крови к печени, а длительно нарастающая — одновременно и ухудшением оттока. Повышение тонуса средних и мелких сосудов печени, снижение скорости их кровенаполнения прямо пропорциональны длительности холестаза. Все это свидетельствует о резком ухудшении кровообращения в печени.
Циркуляторная гипоксия корригируется назначением препаратов, улучшающих микроциркуляцию печеночной ткани,— эуфил-лина, но-шпы, питуитрина, компламина, пентоксифиллина, гепарина, декстранов в общепринятых дозах.
Гемическая гипоксия у больных с Рубцовыми стриктурами желчных протоков обычно мало выражена в предоперационный период, однако значение ее резко возрастает во время операции и непосредственно после нее. В профилактике и лечении гемической гипоксии решающее значение имеет своевременное и адекватное восполнение кровопотери. Считаем недопустимым снижение гемоглобина менее 80 г/л при гематокритном числе не менее 35.
Наиболее эффективным методом удаления гистотоксических соединений является гемосорбция. Однако она связана с риском развития сепсиса при наличии в организме недренированных гнойных очагов, которыми могут являться абсцессы при гнойном холангите. Поэтому в качестве предоперационной подготовки гемо-сорбцию следует проводить только у тяжелобольных, когда другие лечебные мероприятия не эффективны.
Обтурационная желтуха также вызывает увеличение продукции и выделения лимфы печенью. Поэтому временное дренирование грудного протока и лимфосорбция патогенетически обоснованы как до операции, так и после нее. Максимальный лечебный эффект этих методов отмечается через 1—2 сут, и именно в этот период производят основную операцию.
Форсированный диурез — назначение мочегонных средств после водной нагрузки — также способствует выведению токсических продуктов метаболизма. Во время форсированного диуреза необходима коррекция уровня калия в крови. Последнее особенно важно, так как желтуха сопровождается гипокалиемией.
Для коррекции окислительно-восстановительных процессов в печени назначают внутривенно аскорбиновую кислоту до 800 мг в сутки, цианокобаламин — до 500 мг в сутки, кальция пангамат — до 400 мг в сутки, кокарбоксилазу — до 150 мг в сутки. Для коррекции дефицита янтарной кислоты — одного из продуктов межуточного обмена — назначают натрия сукцинат по 50—-100 мг/кг в сутки.
Повышению дезинтоксикационной функции печени способствует введение глутаминовой кислоты до 3 г в сутки. Последняя принимает участие в обезвреживании аммиака, способствует синтезу ацетилхолина и переносу ионов калия через клеточные мембраны.
Для предотвращения жировой инфильтрации печени назначают метионин по 0,5—1 г внутрь 3 раза в сутки, липокаин по 0,5 г 3 раза в сутки.
Нормализации синтеза фосфолипидов в печени способствует эссенциале, вызывающий регенерацию липидных комплексов митохондрий. Непосредственно перед введением разводят 10 мл препарата в 250—500 мл 5 % раствора глюкозы или фруктозы либо аутокровью 1: 1 и вводят внутривенно в дозе 2000 мг со скоростью 40—50 капель в 1 мин. В сутки делают 2—3 такие инфузии.
Обязательным компонентом предоперационной подготовки является викасол (до 30 мг в сутки) как источник витамина К, необходимого для синтеза протромбина.
При наличии цирроза печени показано применение гормонов (40—80 мг преднизолона в сутки).
Улучшение кислородного кровоснабжения печени вызывает гипербарическая оксигенация при давлении 1,8—2 атм с продолжительностью сеансов 50—90 мин.
Особенности анестезиологического обеспечения операции состоят в том, что из числа препаратов, используемых для преме-дикации, исключают производные фенотиазина, для вводного наркоза применяют виадрил 500—1000 мг или натрия оксибутират по 50—100 мг/кг массы тела и седуксен по 10—20 мг. В качестве основного анестезирующего средства используют натрия оксибутират в сочетании с закисью азота или дроперидолом (0,2 мг/кг) и фентанилом (0,008 мг/кг).
Хирургическое лечение. Повреждения желчных протоков во время операции подлежат немедленной коррекции, если не развился перитонит. В противном случае производят наружное дренирование желчных протоков, а основное вмешательство выполняют через 6—8 нед после ликвидации перитонита и формирования наружного желчного свища.
Все сформированные стриктуры желчных протоков независимо от степени сужения, сопровождающиеся холангитом и желтухой, даже перемежающейся, подлежат хирургическому лечению. Чем раньше оно будет выполнено, тем благоприятнее исход. Операцию производят обычно незамедлительно после предоперационной подготовки и выполнения специальных диагностических методов исследования.
Противопоказаний к хирургическому лечению рубцовых стриктур желчных протоков нет. Однако в зависимости от тяжести состояния больного операция может быть паллиативной или радикальной.
Паллиативные операции у больных со стриктурами желчных протоков выполняют для создания временного наружного дренирования желчных протоков. Спустя 1—2 мес после устранения явлений холестаза и печеночно-почечной недостаточности производят радикальную операцию.
Радикальные операции предусматривают одномоментное устранение патологии и создание оттока желчи в кишечник путем восстановительных или реконструктивных вмешательств.
Операционный доступ. При операциях, связанных с повреждением желчных протоков, производят широкую лапаро-томию для ревизии органов брюшной полости в связи с травмой. Если повреждение желчных протоков наступило во время операции, специального доступа не требуется. При операциях по поводу сформированных стриктур желчных протоков мы предпочитаем пользоваться тем доступом, который был применен во время первой операции.
Оперативные вмешательства у больных с Рубцовыми стриктурами желчных протоков требуют высокой техники и большой осторожности уже при вскрытии брюшной полости.
Длительно существующее нарушение проходимости желчных протоков, особенно у больных, перенесших неоднократные операции, наряду с развитием мощных рубцов, приводит к значительным нарушениям свертывающей системы крови. Разделение сращений вызывает значительную кровопотерю уже в начале операции. Такая кровопотеря особенно опасна у больных с желтухой, так как переливание крови у них связано с определенной опасностью. Поэтому следует постоянно тщательно перевязывать и коагулировать все кровоточащие сосуды.
После вскрытия брюшной полости отыскиваем и выделяем из сращений правый нижний край печени. Затем, разделяя сращения, постепенно освобождаем всю нижнюю поверхность печени. Определяем место нахождения печеночной артерии и ее разветвлений, расположение воротной вены. Освобождаем печеночно-дуоденальную связку и приступаем к идентификации желчных протоков. Ориентиром могут быть культя пузырного протока, остатки шовного материала, подтекание желчи при случайном ранении желчного протока или через свищевое отверстие после иссечения свищевого хода. Через образовавшееся отверстие с помощью металлических зондов легче продолжать выделение и ревизию желчных протоков из зоны рубцового сужения. В сомнительных случаях прибегаем к операционной холангиографии. Однако почти у половины больных со стриктурами желчных протоков поиски последних представляют огромные. трудности и занимают много времени. Часто приходится прибегать к нежелательным пункциям тканей печеночно-дуоденальной связки, которые повторяют, пока не будет получена желчь. После этого выполняем холангиографию, по игле производим ограниченное вскрытие протока, содержащего желчь, затем по зонду, введенному в просвет протока, выделяем остальную часть протока и отыскиваем его рубцово суженную часть. При рубцовом сужении в области слияния долевых желчных протоков в зоне ворот печени для идентификации протоков приходится рассекать паренхиму печени на глубину 0,5—1,5 см. Иногда найти желчные протоки из-за мощных сращений вообще не удается. В этих случаях необходимо произвести холангиографию, пунктируя желчный проток через паренхиму печени или выделив его в области III сегмента печени. План дальнейшего вмешательства составляют после изучения полученных холангиограмм.
После выделения хотя бы небольшого участка желчных протоков дальнейшую идентификацию проводят по имеющемуся ориентиру и металлическому зонду, введенному внутрь протока. Для решения оперативно-тактической задачи необходимо иметь полное представление о протяженности стриктуры, степени циркулярного поражения, состоянии проксимального и дистального отрезков желчных протоков. Если состояние проксимального отдела можно изучить путем зондирования или холангиографии, то представление о дистальном отделе можно получить только после визуального исследования, выделив его из окружающих тканей, что представляет значительные трудности и требует хорошего знания анатомии и опыта выполнения подобных операций, так как этот отдел желчного протока не содержит желчи, он спавшийся и мало чем отличается от окружающих его Рубцовых тканей. В целях более быстрого выявления дистального отдела некоторые хирурги рекомендуют производить вскрытие просвета двенадцатиперстной кишки и ретроградное введение катетера в желчный проток (Dragstedt, Woodward, 1952). Однако такая методика не оправдывает себя, так как если концы желчных протоков выше и ниже стриктуры не удается четко идентифицировать простой диссек-цией элементов печеночно-дуоденальной связки, то использовать нижележащий участок протока для восстановления оттока желчи естественным путем практически не удается из-за значительной протяженности стриктуры. Кроме того, вскрытие двенадцатиперстной кишки и катетеризация большого сосочка ее — достаточно травматичные манипуляции и их не следует выполнять только в диагностических целях.
Изложим общие принципы, лежащие в основе выполнения восстановительных и реконструктивных операций. Наиболее важным является принцип соединения тканей при создании анастомозов любого типа. Идеальным является бесшовный анастомоз, однако создать его нам удалось лишь при выполнении реконструктивных операций и наличии определенных условий. В остальных случаях анастомозирование производили шовным способом, так как клеевые методики еще не нашли достаточного применения в хирургии желчевыводящих путей. Шовный способ предусматривает использование достаточно тонких (3/0, 4/0) нитей из рассасывающихся материалов на атравматической игле. Соединять ткани следует без всякого натяжения, тщательно сопоставляя их края. Все анастомозы с узкими протоками (диаметром 0,6 см и меньше) создают на каркасно-дренажной трубке, один конец которой выводят через ткань печени, другой — через прокол протока или кишки в зависимости от способа операции (возможны и другие варианты). Шов тканей должен быть узловым. Все каркасно-дренажные трубки должны быть управляемыми. Необходимо стремиться к периодическому расширению созданных анастомозов в целях профилактики рецидива заболевания. Доступ к созданному анастомозу должен сохраняться до окончания лечения. Для этого в канале, идущем к анастомозу, оставляют управляемую трубку меньшего диаметра, чем дренажная трубка, но достаточного для того, чтобы сохранился канал, позволяющий провести дилататор.
Успех операции во многом зависит еще и от того, какая часть проксимального отдела желчных протоков пригодна для анасто-мозирования. Чем короче этот участок, тем труднее выполнить операцию и тем хуже прогноз. Если культя протока лежит глубоко в зоне ворот печени или в ее паренхиме, то операция оказывается в высшей степени трудной, анастомоз малонадежным, процент рецидивов и летальность высокими, а процент полного выздоровления крайне низким. Если же культя протока находится вне зоны ворот печени, то выполнить операцию гораздо легче, а прогноз более благоприятный.
Наиболее физиологичным методом хирургического лечения больных с рубцовыми стриктурами желчных протоков является создание билио-билиарных анастомозов, то есть выполнение восстановительных операций, что, к сожалению, не всегда бывает возможным. Тем не менее каждый хирург должен стремиться использовать все возможности, чтобы восстановить естественный желчеток. Преимущества этого метода очевидны: при этом сшивают однородные ткани, восстанавливаются физиологические условия для оттока желчи, воссоздается вся нормальная система защиты вне- и внутрипеченочных желчных протоков от рефлюкса в них пищи и проникновения микроорганизмов из кишечника. Однако такие операции возможны только при ограниченных стриктурах печеночно-желчного протока. Критерием является величина дефекта желчного протока после иссечения рубцовой стриктуры. По данным нашей клиники, для успешного выполнения этих операций дефект не должен превышать 25—30 мм. При выполнении этих операций необходима также полная уверенность в достаточной проходимости большого сосочка двенадцатиперстной кишки. В сомнительных случаях, но при наличии хороших условий для восстановительной операции, оправданным является одновременное выполнение трансдуоденальной или эндоскопической папил-лосфинктеротомии.
Если дефект печеночно-желчного протока превышает 30 мм, то возникает серьезная опасность создания анастомоза с большим натяжением тканей, что является недопустимым, так как возникает угроза расхождения швов, подтекания желчи и рецидива заболевания. В этих случаях или когда дистальный отдел желчных протоков вовсе не удается обнаружить, применяют реконструктивные операции.
Следует также подчеркнуть, что при наложении анастомоза необходимо сшивать здоровые ткани, а значит, величина дефекта должна быть определена после иссечения рубцовых тканей, так как первое зрительное впечатление о протяженности стриктуры до ее иссечения, как правило, бывает неправильным.
В последние годы появился еще один способ лечения всех видов рубцовых стриктур желчных протоков, который применяют независимо от их локализации, протяженности и даже состояния больного. Имеется в виду чрескожная чреспеченочная дилатация суженных участков желчных протоков, обусловленных либо рубцовой стриктурой, либо возникшим сужением ранее созданного анастомоза в результате восстановительной или реконструктивной операции. Возможности этого метода наглядно демонстрируют рентгенограммы, представленные на рис. 83 и 84.
Date: 2015-09-18; view: 868; Нарушение авторских прав