
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретическое введение
|
|
Естественнонаучный факультет
Кафедра «Химии»
ДИСЦИПЛИНА ХИМИЯ
Отчет по лабораторной работе
ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
| Лабораторную работу выполнил | _________ (подпись) | студент группы ______ |
| ___________________________(ФИО) | ||
| Дата выполнения работы | _______________ | |
| Лабораторную работу принял | _________ (подпись) | Лапина С.Ф., доц. каф. Химии, к.фарм.н. |
| Рейтинговый бал: | подготовка ______ отчет ______ тематитическая карточка ______ | |
| Итого ______ | ||
Братск 2012 г.
Цель работы – определение теплового эффекта реакции нейтрализации при взаимодействии сильной кислоты с сильным основанием.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Химические реакции сопровождаются выделением или поглощением энергии (теплоты). Первые называются экзотермическими, вторые – эндотермическими.
Количество выделенной или поглощенной теплоты называют тепловым эффектом процесса (Q). Последний зависит от природы веществ, их количества, агрегатного состояния и температуры процесса. Изучением тепловых эффектов химических процессов занимается термохимия.
Большинство химических процессов протекают при постоянном давлении (р=const), т.е. является изобарными. Для изобарных процессов тепловой эффект равен разности энтальпий (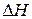 ) конечного и исходного состояния системы, характеризующей «теплоспособность» системы:
) конечного и исходного состояния системы, характеризующей «теплоспособность» системы:
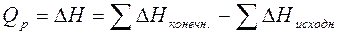
Величина (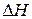 ) – энтальпия химической реакции - измеряется в кДж. Для экзотермических реакций (
) – энтальпия химической реакции - измеряется в кДж. Для экзотермических реакций (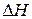 ) < 0, для эндотермических - (
) < 0, для эндотермических - (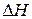 ) > 0. Изменение энтальпии (тепловой эффект химической реакции), а также агрегатное состояние каждого из исходных веществ и продуктов реакции указывают в термохимических уравнениях. Кроме этого, в них допускается применение дробных коэффициентов, так как тепловой эффект рассчитывается на один моль вещества.
) > 0. Изменение энтальпии (тепловой эффект химической реакции), а также агрегатное состояние каждого из исходных веществ и продуктов реакции указывают в термохимических уравнениях. Кроме этого, в них допускается применение дробных коэффициентов, так как тепловой эффект рассчитывается на один моль вещества.
Пример термохимического уравнения:
(NH4)2Cr2O7(к) = N2(г) + Cr2O3(к) + 4H2O(ж); 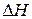 = -477 кДж.
= -477 кДж.
В данной записи (к), (г), (ж) означают соответственно кристаллическое, газообразное и жидкое состояния.
Для термохимических расчетов важна стандартная энтальпия образования соединений ΔНообр – это тепловой эффект реакции образования 1 моля этого соединения из простых веществ, устойчивых при стандартных условиях (температура 298 К и давление 101,3 кПа).
Основным законом термохимии является закон Г.И.Гесса, согласно которому изменение энтальпии (внутренней энергии) в химической реакции определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от начальных веществ к конечным.
Следствием из закона Гесса является соотношение:
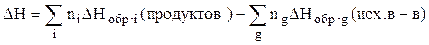
Где 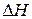 – энтальпия химической реакции.
– энтальпия химической реакции.
Первый член в правой части уравнения – сумма энтальпий образования продуктов реакции, взятых с учетом стехиометрических коэффициентов в уравнении реакции;
Второй член – аналогичная сумма для исходных веществ.
Известно, что нейтрализация 1 эквивалента любой сильной кислоты любым сильным основанием в разбавленных водных растворах сопровождается экзотермическим эффектом, при 298 К равным – 57,22 кДж/моль.
Это объясняется тем, что изменение энтальпии таких реакций не зависят от исходных веществ, и определяется при взаимодействии любых сильных кислот и щелочей реакцией:
Н+(р) + ОН - (р) = Н2О (ж); 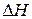 = -57,22 кДж/моль
= -57,22 кДж/моль
Этот факт подтверждает полную диссоциацию сильных электролитов в водных растворах. Например, нейтрализация азотной кислоты гидроксидом калия в разбавленных водных растворах сводится к образованию 1 моля жидкой воды, что следует из ионно-молекулярного уравнения реакции:
НNO3 + KOH = KNO3 + H2O (ж)
Н+з (р) + NO-3 (р) + K+ (р) + OH- = K+(p) + NO-3 (p) + H2O (ж)
Н+ + ОН- = Н2О (ж)
Date: 2015-09-18; view: 721; Нарушение авторских прав