
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние температуры на направление реакции
|
|
Согласно уравнению Δ G = Δ Н – T Δ S влияние температуры на Δ G определяется знаком и величиной Δ S. На рис. 2 показана зависимость Δ G ряда реакций от температуры. Если пренебречь влиянием Т на значения Δ Н и Δ S, то приведённая зависимость Δ G = ƒ(T)
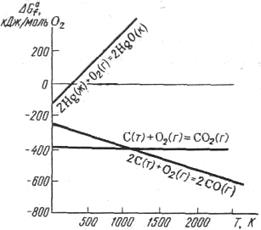 является уравнением прямой, наклон которой определяется знаком Δ S. На рис. 2 при Δ S >0 прямая идет вниз, при Δ S <0 – вверх. Для реакции
является уравнением прямой, наклон которой определяется знаком Δ S. На рис. 2 при Δ S >0 прямая идет вниз, при Δ S <0 – вверх. Для реакции
2C (графит) + O2 (г) = 2СО (г), Δ S >0,
протекающей с увеличением энтропии, повышение температуры приводит к увеличению отрицательного значения Δ G. Высокотемпературный режим благоприятствует протеканию процесса. Для реакции 2Hg (ж) + O2 (г) = 2HgO (к), Δ S <0,
Рис. 2. Зависимость Δ G ряда
оксидов от температуры
протекающей с уменьшением энтропии, с повышением температуры отрицательное значение Δ G уменьшается. Следовательно, в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре Δ G приобретает положительное значение, и тогда реакция должна протекать в обратном направлении. Как видно на рис. 2, изменение знака Δ G для этой реакции достигается при 500 К. Выше этой температуры реакция протекает в обратном направлении:
2HgO (к) = 2Hg (ж) + O2 (г), Δ S >0
Таким образом, при низкотемпературном режиме (до 500 К) ртуть окисляется кислородом, в то время как при высокотемпературном режиме (выше 500 К) оксид ртути распадается с выделением кислорода. Эти процессы можно использовать для получения кислорода в лаборатории.
Если же при протекании процесса энтропия системы не изменяется, то значение Δ G от температуры практически не зависит. Так, для реакции
C (графит) + O2 (г) = СО2 (г), Δ S ≈0
зависимость Δ G = ƒ(T) на рис.2 изображена прямой, практически параллельной оси абсцисс.
Процессы, протекающие с уменьшением энтальпии (Δ Н < 0) и увеличением энтропии (Δ S > 0), практически необратимы. В этом случае Δ G всегда будет иметь отрицательное значение, какую бы температуру ни приняли.
Date: 2015-09-18; view: 1152; Нарушение авторских прав