
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вопрос 11. Теория соответственных состояний. Коэффициент сжимаемости
|
|
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в него поправочного коэффициента (z), называемого коэффициентом сжимаемости
 .
.
Коэффициент сжимаемости (z)учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Коэффициент сжимаемости является функцией давления, температуры и зависит от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В критической точке для всех веществ r = 0,  ,
, 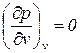 ,
, 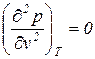 . Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.
. Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.
Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления  ; приведенной температуры
; приведенной температуры 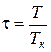 ; приведенного объема
; приведенного объема 
.
Уравнение состояния, записанное в виде F (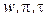 ) = 0, называется приведенным уравнением состояния. Оно не содержит индивидуальных констант вещества.
) = 0, называется приведенным уравнением состояния. Оно не содержит индивидуальных констант вещества.
Состояния вещества, в которых они имеют одинаковые  и
и  называются соответственными. Зная параметры
называются соответственными. Зная параметры  и
и  по данным рис. 1.4 определяется коэффициент сжимаемости z.
по данным рис. 1.4 определяется коэффициент сжимаемости z.
12. Математическое выражение 1го начала термодинамики (+баланс рабочего тела).
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Это утверждение и принимается в качестве постулата первого начала термодинамики
Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии:
Внутренняя энергия изолированной системы сохраняет своё постоянное значение при всех изменениях, протекающих внутри системы, то есть  . Изменение внутренней энергии неизолированной системы складывается из подведённой (отведённой) теплоты и подведённой (отведённой) работы, то есть
. Изменение внутренней энергии неизолированной системы складывается из подведённой (отведённой) теплоты и подведённой (отведённой) работы, то есть 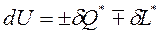 .
.
 в интегральной форме:
в интегральной форме: 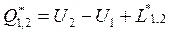
 - эффективная работа;
- эффективная работа;  - внешний теплообмен
- внешний теплообмен
Полученные уравнения учитывают только внешние эффекты и справедливы только для обратимых процессов.
 Уравнения являются математическим выражением первого начала термодинамики по внешнему балансу теплоты и работы и гласят: количество теплоты, подведенное извне, идет на изменение внутренней энергии системы и совершение работы.
Уравнения являются математическим выражением первого начала термодинамики по внешнему балансу теплоты и работы и гласят: количество теплоты, подведенное извне, идет на изменение внутренней энергии системы и совершение работы.
В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
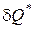 =
= 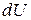 +
+ 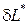 Первого начала термодинамики по внешнему балансу.
Первого начала термодинамики по внешнему балансу.
Работа необратимых потерь  , связанная с затратами энергии на преодоление сил трения, удары и завихрения, превращается в теплоту внутреннего теплообмена (
, связанная с затратами энергии на преодоление сил трения, удары и завихрения, превращается в теплоту внутреннего теплообмена ( )
)
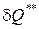 =
= 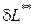 .Полное количество теплоты
.Полное количество теплоты 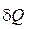 , полученное телом, равно сумме теплоты, подведенной извне
, полученное телом, равно сумме теплоты, подведенной извне 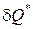 , и теплоты внутреннего теплообмена
, и теплоты внутреннего теплообмена 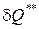 .
.

 ;
;  .
.
Уравнения (1.55) и (1.56) называются уравнениями первого начала термодинамики по балансу рабочего тела, и справедливы для реальных процессов.
Первое начало термодинамики по балансу рабочего тела:  , где
, где  - полный или приведённый теплообмен.
- полный или приведённый теплообмен.
Полное количество теплоты 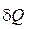 , полученное телом, равно сумме теплоты, подведенной извне
, полученное телом, равно сумме теплоты, подведенной извне 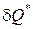 , и теплоты внутреннего теплообмена
, и теплоты внутреннего теплообмена 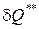
Первое начало термодинамики по балансу рабочего тела справедливо для любых процессов протекающих в системе.
В условиях обратимого процесса, то есть 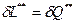 , первое начало термодинамики по балансу рабочего тела переходит в первое начало термодинамики по внешнему балансу. Для использования этого уравнения нужно уметь его интегрировать. При интегрировании получится:
, первое начало термодинамики по балансу рабочего тела переходит в первое начало термодинамики по внешнему балансу. Для использования этого уравнения нужно уметь его интегрировать. При интегрировании получится: 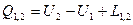 для необратимых процессов и
для необратимых процессов и  для обратимых процессов.
для обратимых процессов.
Date: 2015-09-18; view: 1375; Нарушение авторских прав