
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкость. Определение теплоемкости веществ
|
|
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают массовую теплоемкость с, измеряемую в Дж/(кг×К), молярную 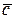 – Дж/(кмоль×К) и объемную с' – Дж/(м3×К).
– Дж/(кмоль×К) и объемную с' – Дж/(м3×К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
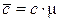 ;
; 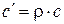 . (1.12)
. (1.12)
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием
z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
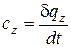 . - Эта теплоемкость называется истинной.
. - Эта теплоемкость называется истинной.
Экспериментальное определение теплоемкости проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
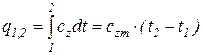 .
. 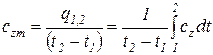 .
.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону
 .
. 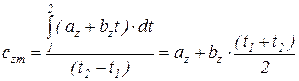 , (1.17)
, (1.17)
где сzm - называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
6-7. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
Термодинамическая смесь – система, состоящая из  химически невзаимодействующих друг с другом компонентов.
химически невзаимодействующих друг с другом компонентов.
Состав смеси задаётся либо массовой концентрацией компонентов - 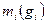 , либо молярным составом -
, либо молярным составом - 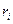 (объёмный).
(объёмный).
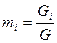 , где
, где 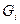 - масса одного компонента смеси,
- масса одного компонента смеси, 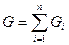 - масса всей смеси
- масса всей смеси 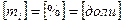
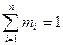
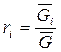
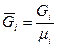 - число Кмолей вещества,
- число Кмолей вещества, 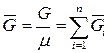 - число Кмолей смеси
- число Кмолей смеси
. 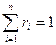
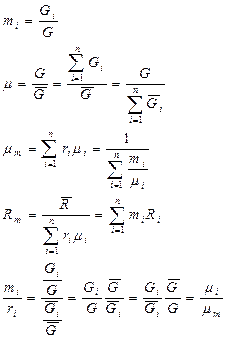
Если смесь является идеальным газом, то 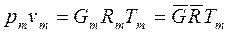 .
.
Если смесь является реальным газом, то 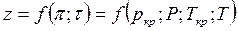 .
.
Псевдокритические параметры:
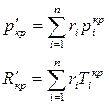
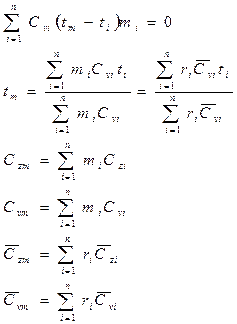 Схемы смешивания газов.
Схемы смешивания газов.
1. 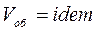 , следовательно
, следовательно 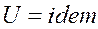 .
.
2. 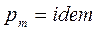 , следовательно
, следовательно 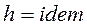 .
.
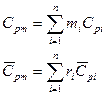
Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
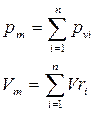
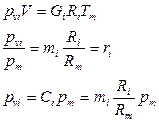
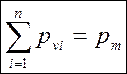
Date: 2015-09-18; view: 775; Нарушение авторских прав