
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вопрос 10. Критические параметры чистого вещества и смесей
|
|
Критические параметры являются важнейшими термодинамическими постоянными вещества. Критическая температура  – это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление
– это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление 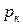 – это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние никаким изменением температуры.
– это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние никаким изменением температуры.
В закритической области (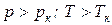 ) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии
) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии 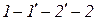 (рис. 1.3).
(рис. 1.3).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния 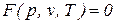 , описывающее любое однофазное состояние вещества. Такого уравнения пока еще не получено. Ниже рассмотрим уравнения состояния идеальных и реальных газов.
, описывающее любое однофазное состояние вещества. Такого уравнения пока еще не получено. Ниже рассмотрим уравнения состояния идеальных и реальных газов.
Идеальными газами называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Уравнение состояния идеальных газов - уравнение Клапейрона:
для 1 кг газа 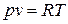 ; для
; для 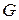 кг газа
кг газа 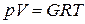 ,
,
где  – характеристическая постоянная газа; Т – абсолютная температура газа
– характеристическая постоянная газа; Т – абсолютная температура газа
Используя уравнение Авагадро уравнение Клапейрона можно привести к виду:
для 1 кмоля газа 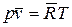 ; для
; для  кмолей газа
кмолей газа 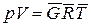
где 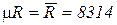 (Дж/кмоль К) – универсальная газовая постоянная, не зависит от природы газов
(Дж/кмоль К) – универсальная газовая постоянная, не зависит от природы газов
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния.
Date: 2015-09-18; view: 1281; Нарушение авторских прав