
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закони ідеальних газів
|
|
Газоподібний стан характеризується слабкою взаємодією між молекулами, і тому властиві для нього закономірності залежать насамперед не від природи молекул газу, а від їх числа в одиниці об’єму та температури.
Фізичні властивості газів (на відміну від рідин та твердих речовин):
ü заповнюють весь наданий їм об’єм;
ü під дією зовнішнього тиску здатні сильно змінювати об’єм, стискатися, а під час розширення заповнювати весь об’єм;
ü необмежено змішуються між собою з утворенням однорідної газової суміші.
Газовий стан описують за допомогою таких характеристик:
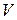 – об’єм,
– об’єм, 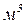 ;
;
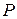 – тиск,
– тиск, 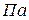 ;
;
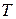 – температура,
– температура, 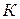 ;
;
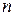 – кількість речовини газу,
– кількість речовини газу, 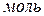 .
.
Закон Бойля – Маріотта
(залежність між тиском і об’ємом певної кількості газу за сталої температури)
За сталої температури добуток тиску на об’єм є сталою величиною.
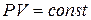
В разі підвищення тиску в певне число разів у стільки ж разів зменшується об’єм, а розширення газу завжди супроводжується зменшенням тиску. Якщо для однієї й тієї самої кількості газу змінювати тиск і вимірювати об’єм, то за сталої температури:
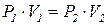
Закон Шарля
(залежність між тиском газу, що підвищується під час нагрівання, та його температурою за сталих об’єму і кількості газу)
Тиск газу за незмінних маси та об’єму пропорційний абсолютній температурі.
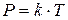
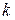 – коефіцієнт пропорційності.
– коефіцієнт пропорційності.
Закон Гей – Люссака
(залежність об’єму газу, що розширюється під час нагрівання, від температури за сталих тиску та кількості газу)
Об’єм газу за незмінних маси і тиску прямо пропорційний його абсолютній температурі.
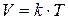
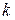 – коефіцієнт пропорційності.
– коефіцієнт пропорційності.
Цей закон використовується для зіставлення об’єму і температури однієї кількості газу у двох різних станах. Якщо тиск для одного й того ж самого зразка газу залишається сталим, то за різних температур сталим також буде співвідношення 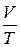 :
:
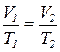
Закон Менделєєва – Клапейрона
(об’єднаний закон стану ідеального газу)
Застосовується у разі, коли потрібно знайти об’єм за умов одночасної зміни температури і тиску:
Відношення добутку тиску на об’єм газу до його абсолютної температури для даної маси газу є сталою величиною.
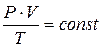
Для 1 моль газу за н.у. 
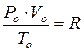 універсальна газова стала
універсальна газова стала
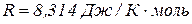
Універсальній газовій сталій відповідає робота, яку виконує під час розширення один моль газу в разі його нагрівання на один градус.

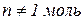
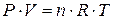
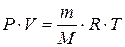
Якщо взяти певну кількість газу, то вплив одночасної зміни тиску і температури на об’єм газу можна виразити таким співвідношенням:
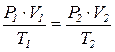
Date: 2015-09-05; view: 493; Нарушение авторских прав