
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон еквівалентів
|
|
Еквівалент елемента – частка атома, що припадає на одиницю валентності. Еквівалент елемента – така його кількість, яка з’єднується з 1 моль атомів 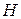 чи заміщує ту ж саму кількість атомів
чи заміщує ту ж саму кількість атомів 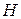 в хімічних реакціях.
в хімічних реакціях.
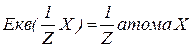
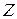 - валентність елемента у сполуці.
- валентність елемента у сполуці.
Еквівалент нітрогену в 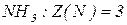
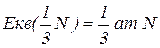
Еквівалент нітрогену в 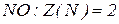
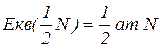
Еквівалент нітрогену в 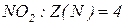
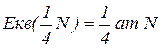
Еквівалентна маса – частина атомної маси, що припадає на одиницю валентності; чисельно дорівнює масі одного еквівалента елемента, вираженої в а.о.м.
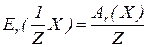
Еквівалентна маса нітрогену в 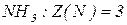
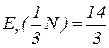
Еквівалентна маса нітрогену в 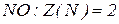
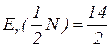
Еквівалентна маса нітрогену в 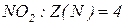
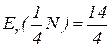
Молярна маса еквівалентів – чисельно дорівнює еквівалентній масі і виражається в г/моль.
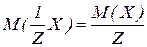
Молярна маса еквівалентів нітрогену в 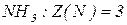
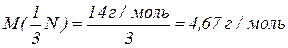
Молярна маса еквівалентів нітрогену в 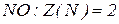

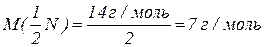
Молярна маса еквівалентів нітрогену в 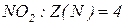
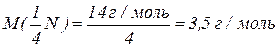
Еквівалент складних сполук.
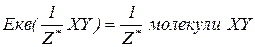
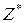 – фактор еквівалентності (число еквівалентності).
– фактор еквівалентності (число еквівалентності).
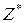 для кислот – це їх основність (кількість активних атомів гідрогену).
для кислот – це їх основність (кількість активних атомів гідрогену).
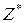 для гідроксидів – це їх кислотність (кількість груп
для гідроксидів – це їх кислотність (кількість груп 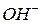 ).
).
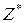 для солей – це добуток валентності металу на кількість атомів металу у формульній одиниці.
для солей – це добуток валентності металу на кількість атомів металу у формульній одиниці.
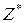 для оксидів – це подвійна кількість атомів оксигену.
для оксидів – це подвійна кількість атомів оксигену.
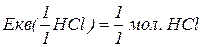
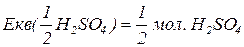
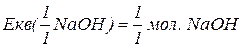
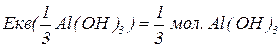
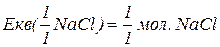
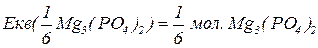
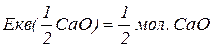
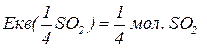
Еквівалентна маса складних сполук – відношення молекулярної маси речовини до фактору еквівалентності.
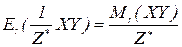
Молярна маса еквівалентів складних сполук – відношення молярної маси речовини до фактору еквівалентності. Чисельно дорівнює еквівалентній масі і виражається в г/моль.
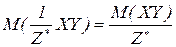
H3PO4
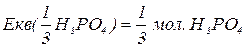
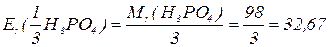
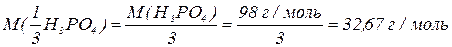
В реакціях, які проходять без зміни ступенів окиснення елементів,  для однієї і тієї ж самої речовини може приймати різні значення в залежності від реакції, в яку вона вступає. Максимально можливе значення
для однієї і тієї ж самої речовини може приймати різні значення в залежності від реакції, в яку вона вступає. Максимально можливе значення  визначається за кількістю зв’язків, які сполучають основні складові частини речовини. Наприклад, для кислот
визначається за кількістю зв’язків, які сполучають основні складові частини речовини. Наприклад, для кислот  відповідає їх основності, тобто кількості атомів
відповідає їх основності, тобто кількості атомів 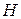 , зв’язаних з кислотним залишком, здатних заміщуватися на метал. Але якщо кислота не використовує в реакції всі атоми гідрогену, то її
, зв’язаних з кислотним залишком, здатних заміщуватися на метал. Але якщо кислота не використовує в реакції всі атоми гідрогену, то її  буде меншим за максимальне значення, і визначається реальною кількістю атомів гідрогену у молекулі кислоти, що заміщуються на метал, утворюючи певні продукти реакції. Наприклад, для ортофосфатної кислоти:
буде меншим за максимальне значення, і визначається реальною кількістю атомів гідрогену у молекулі кислоти, що заміщуються на метал, утворюючи певні продукти реакції. Наприклад, для ортофосфатної кислоти:
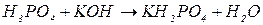
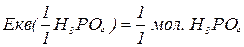
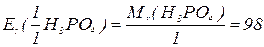
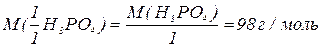
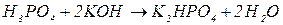
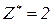
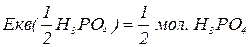
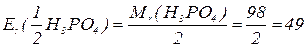

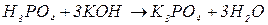
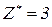
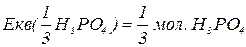
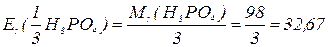
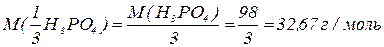
Для основ  відповідає їх кислотності, тобто кількості груп
відповідає їх кислотності, тобто кількості груп 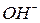 , зв’язаних з катіонами металу, здатних заміщуватися на кислотний залишок. Але якщо основа не використовує в реакції всі групи
, зв’язаних з катіонами металу, здатних заміщуватися на кислотний залишок. Але якщо основа не використовує в реакції всі групи 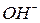 , то її
, то її  буде меншим за максимальне значення, і визначається реальною кількістю груп
буде меншим за максимальне значення, і визначається реальною кількістю груп 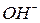 у молекулі основи, що заміщуються на кислотний залишок, утворюючи певні продукти реакції. Наприклад, для гідроксиду алюмінію:
у молекулі основи, що заміщуються на кислотний залишок, утворюючи певні продукти реакції. Наприклад, для гідроксиду алюмінію:
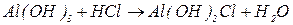
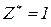
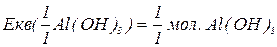
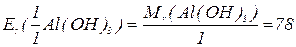
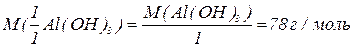
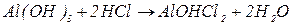
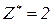
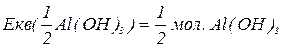
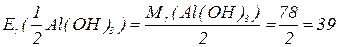
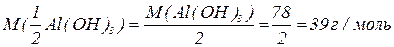
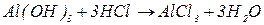
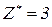
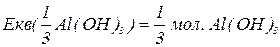
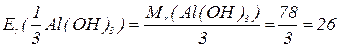
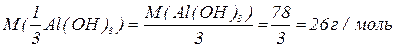
В окисно-відновних реакціях частинкою, еквівалентною атому гідрогену, є електрон, тому 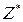 дорівнює числу електронів, приєднаних або відданих частинкою в певній реакції.
дорівнює числу електронів, приєднаних або відданих частинкою в певній реакції.

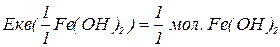
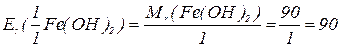
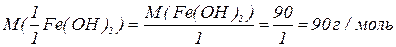
Закон еквівалентів:
Маси реагуючих елементів співвідносяться між собою так само, як їх еквівалентні маси.
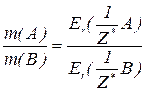
У разі утворення хімічних сполук на одиницю валентності одного атома припадає одиниця валентності іншого атома, а кожній одиниці валентності відповідає одиниця еквівалента елемента: на один еквівалент одного елемента в хімічних реакціях припадає один еквівалент іншого елемента.
Для визначення еквівалентних мас складних речовин можна використати те, що еквівалентна маса речовини відповідає сумі еквівалентних мас її складових частин. Наприклад, за визначенням, кислоти містять атоми гідрогену, здатні заміщуватися на атоми металу, зв'язані з кислотними залишками. Тому еквівалентну масу кислоти можна визначити, додавши еквівалентну масу гідрогену (що дорівнює 1) та еквівалентну масу кислотного залишку. Цей принцип застосовується і до розрахунку еквівалентних мас інших складних речовин (основ, солей, оксидів).
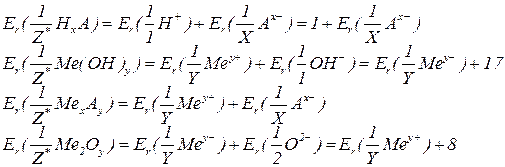
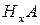 – кислота;
– кислота;
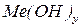 – гідроксид;
– гідроксид;
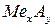 – сіль;
– сіль;
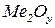 – оксид.
– оксид.
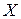 - заряд кислотного залишку;
- заряд кислотного залишку;
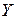 - заряд катіона металу;
- заряд катіона металу;
Date: 2015-09-05; view: 1224; Нарушение авторских прав