
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способи добування амфотерних гідроксидів
|
|
Для добування амфотерних гідроксидів застосовують реакцію обміну між сіллю металу (у розчині) та розчином лугу чи аміаку. Щоб запобігти розчиненню амфотерних гідроксидів у надлишку лугів, дотримуються молярних співвідношень реагентів відповідно до рівнянь реакцій. В осад повинен випадати тільки гідроксид, який необхідно добути. Решта учасників реакції повинні бути добре розчинними.
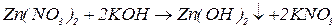
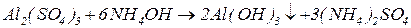
Солі
Солями називають сполуки, які складаються з катіона металу та аніона кислотного залишку і є продуктами заміщення гідрогену кислоти металом або продуктами обміну гідроксигрупи гідроксидів металів на кислотні залишки кислот.
Солі поділяються на середні, кислі, основні та комплексні.
Середні солі є продуктами повного заміщення атомів гідрогену кислоти на катіони металів (наприклад 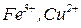 , ін.) чи амонію (
, ін.) чи амонію (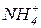 ). До середніх солей належать, наприклад,
). До середніх солей належать, наприклад, 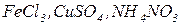 . Якщо катіон металу зв’язаний з двома різними кислотними залишками (аніонами), такі солі називають змішаними. Змішані солі можуть утворювати лише багатокислотні основи. До змішаних солей можна віднести, наприклад,
. Якщо катіон металу зв’язаний з двома різними кислотними залишками (аніонами), такі солі називають змішаними. Змішані солі можуть утворювати лише багатокислотні основи. До змішаних солей можна віднести, наприклад, 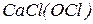 , яка є сіллю двох кислот – хлоридної (
, яка є сіллю двох кислот – хлоридної (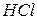 ) та гіпохлоритної (
) та гіпохлоритної (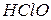 ). Якщо атоми гідрогену багатоосновної кислоти заміщено на катіони різних металів (чи катіони амонію), то такі солі відносять до подвійних, наприклад
). Якщо атоми гідрогену багатоосновної кислоти заміщено на катіони різних металів (чи катіони амонію), то такі солі відносять до подвійних, наприклад 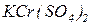 ,
, 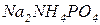 . Як подвійні, так і змішані солі як індивідуальні сполуки відомі лише в кристалічному стані, оскільки в розчинах вони повністю дисоційовані на катіони металів та кислотні залишки.
. Як подвійні, так і змішані солі як індивідуальні сполуки відомі лише в кристалічному стані, оскільки в розчинах вони повністю дисоційовані на катіони металів та кислотні залишки.
Назви середніх солей складаються з назв кислотного залишку в називному відмінку і залишку основи в родовому відмінку. Наприклад,  - сульфат калію,
- сульфат калію, 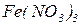 - нітрат феруму (ІIІ),
- нітрат феруму (ІIІ), 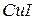 - йодид купруму (І).
- йодид купруму (І).
Середні солі реагують:
а. з кислотами за реакціями обміну, якщо утворюються:
важкорозчинні солі:
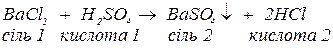
важкорозчинні кислоти:
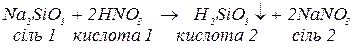
нестійкі кислоти:
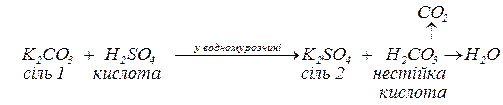
леткі кислоти:

слабкі кислоти:
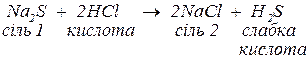
Якщо середня сіль реагує з однойменною багатоосновною кислотою, утворюються кислі солі:

б. з кислотними оксидами (за нагрівання) з утворенням нової солі та нового кислотного оксиду, якщо останній більш леткий, ніж той, що вступив у реакцію:
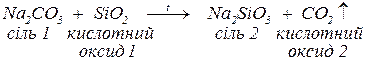
в. з основами, утворюючи за реакціями обміну основні солі (за нестачі основи) або відповідні малорозчинні основні чи амфотерні гідроксиди. Якщо гідроксид металу, що може утворитися, є амфотерним, то, за надлишку сильної основи, утворюються комплексні солі:
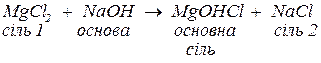

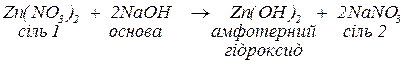

г. з середніми солями за реакціями обміну, якщо в результаті може утворитися інша малорозчинна середня сіль:
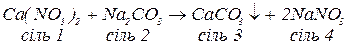
Кислі солі – продукти неповного заміщення гідрогену кислоти на катіони металів. Утворення кислих солей характерно тільки для багатоосновних кислот. Кислі солі складаються з катіона металу, кислотного залишку та гідрогену, здатного заміщуватись на катіон металу (наприклад 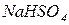 ,
, 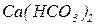 ). Принцип складання формул кислих солей можна подати за допомогою таблиці 3:
). Принцип складання формул кислих солей можна подати за допомогою таблиці 3:
Табл.3
| Формула кислоти | Залишки кислоти | Формули солей |
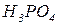
| 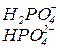
| 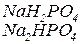 -кислі солі -кислі солі
|

| 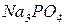 -середня сіль -середня сіль
| |
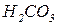
| 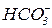
| 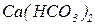 -кисла сіль -кисла сіль
|
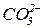
| 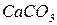 -середня сіль -середня сіль
|
Назви кислих солей утворюють з назв середніх солей, додаючи префікс гідро -: 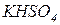 - гідросульфат калію,
- гідросульфат калію, 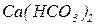 - гідрокарбонат кальцію. Якщо в кислій солі є декілька атомів гідрогену, вказують їх кількість:
- гідрокарбонат кальцію. Якщо в кислій солі є декілька атомів гідрогену, вказують їх кількість: 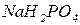 - дигідроортофосфат натрію (дигідрофосфат натрію),
- дигідроортофосфат натрію (дигідрофосфат натрію), 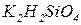 - дигідроортосилікат калію.
- дигідроортосилікат калію.
У хімічних реакціях кислі солі можуть поводитися аналогічно до середніх солей (наприклад вступати в реакції обміну з іншими солями) або до кислот (реагуючи з основами, утворюючи середні солі).
Кислі солі реагують:
а. з кислотами за реакціями обміну, якщо утворюються:
важкорозчинні кислоти:
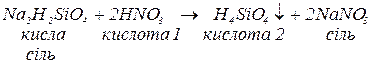
нестійкі кислоти:
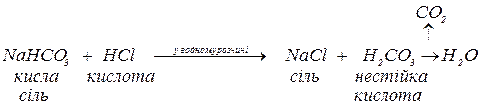
леткі кислоти:

слабкі кислоти:
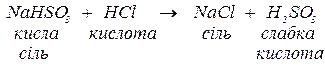
б. з середніми солями, утворюючи внаслідок реакції обміну
малорозчинні солі (тобто поводяться аналогічно до середніх солей):
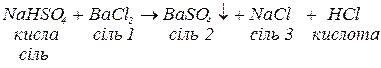
слабкі, малорозчинні або нестійкі кислоти, якщо кислота, яка утворювала кислу сіль, є достатньо сильною. У цьому випадку кисла сіль поводить себе аналогічно до кислот:
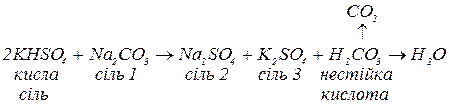
в. з основними солями, утворюючи внаслідок часткової нейтралізації середні солі та воду:
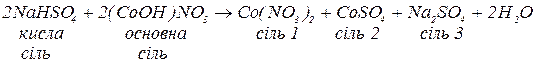
г. з основами, утворюючи кислі (за нестачі лугу), середні або комплексні солі (за надлишку лугу, якщо вихідна сіль утворена залишком амфотерного гідроксиду):
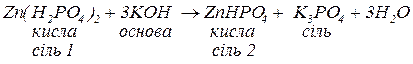

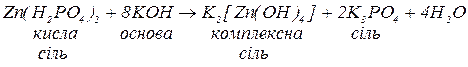
Основні солі – продукти неповного заміщення гідроксильних груп гідроксидів на кислотні залишки. Утворення основних солей характерно тільки для багатокислотних гідроксидів. Подібно до середніх солей, основні солі складаються з залишку основи (багатокислотної) та залишку кислоти. Залишок основи містить атом металу та одну або декілька гідроксигруп (наприклад  ). Принцип складання формул основних солей можна подати за допомогою таблиці 4:
). Принцип складання формул основних солей можна подати за допомогою таблиці 4:
Табл.4
| Формула амфотерного гідроксиду або основи | Залишки амфотерного гідроксиду чи основи | Формули солей |
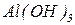
| 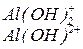
|  -основні солі -основні солі
|
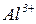
| 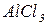 -середня сіль -середня сіль
| |
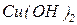
| 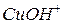
| 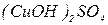 -основна сіль -основна сіль
|
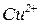
| 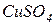 -середня сіль -середня сіль
|
Назви основних солей утворюють з назв середніх солей, додаючи префікс гідрокси -: 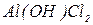 - гідроксихлорид алюмінію,
- гідроксихлорид алюмінію, 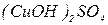 - гідроксисульфат купруму (ІІ). Якщо в основній солі є декілька гідроксильних груп, вказують їх кількість:
- гідроксисульфат купруму (ІІ). Якщо в основній солі є декілька гідроксильних груп, вказують їх кількість: 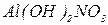 - дигідроксинітрат алюмінію,
- дигідроксинітрат алюмінію, 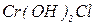 - дигідроксихлорид хрому (ІІІ).
- дигідроксихлорид хрому (ІІІ).
Основні солі реагують:
а. з кислотами, утворюючи середні солі:
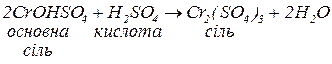
Утворюється одна сіль, бо кислота та вихідна основна сіль мають однакові кислотні залишки.

Утворюються дві солі, бо кислота та вихідна основна сіль мають різні кислотні залишки.
б. з основами, утворюючи малорозчинні гідроксиди, основні солі (за нестачі основи), а за надлишку лугу та наявності залишку амфотерного гідроксиду у складі вихідної солі — комплексну сіль:
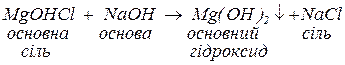
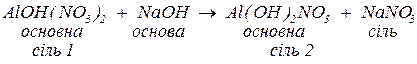
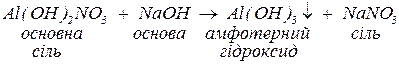
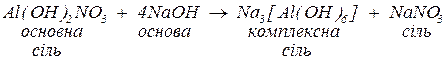
Комплексні солі – сполуки, до складу яких входять комплексні частинки, що складаються з центрального атома чи іона (комплексоутворювача), оточеного лігандами.
Комплексоутворювач – центральний атом чи іон, до якого приєднуються нейтральні молекули або іони. Оскільки комплексні частинки утворюються за донорно-акцепторним механізмом, то комплексоутворювачі мають бути акцепторами електронів і мати вільні електронні орбіталі. Наприклад, у комплексній солі 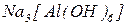 комплексоутворювачем є іон
комплексоутворювачем є іон 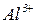 , у
, у 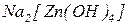 - іон
- іон 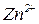 .
.
Ліганди (приєднані частинки) – молекули або іони, які координуються навколо комплексоутворювача і є донорами електронів. Наприклад, у комплексних солях 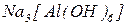 та
та 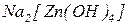 лігандами є іони
лігандами є іони 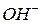 . Число атомів ліганду, які одночасно можуть утворювати зв’язки з комплексоутворювачем, називають дентатністю. Наприклад,
. Число атомів ліганду, які одночасно можуть утворювати зв’язки з комплексоутворювачем, називають дентатністю. Наприклад, 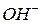 є монодентатним, оскільки здатний утворити лише один хімічний зв’язок, використовуючи одну з неподілених електронних пар атома оксигену.
є монодентатним, оскільки здатний утворити лише один хімічний зв’язок, використовуючи одну з неподілених електронних пар атома оксигену.
Координаційне число визначається числом місць у просторі, які може надавати комплексоутворювач для приєднання лігандів (число хімічних зв’язків між комплексоутворювачем і лігандами). Координаційне число для іонів залежить від електронної будови іона-комплексоутворювача та від його радіуса. Найчастіше координаційні числа дорівнюють 4 та 6. Наприклад, у комплексній солі 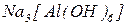 координаційне число іона
координаційне число іона 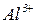 дорівнює 6, у
дорівнює 6, у 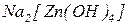 координаційне число іона
координаційне число іона 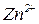 - 4.
- 4.
Внутрішню координаційну сферу комплексної солі складають комплексоутворювач разом з лігандами, які приєдналися відповідно до координаційного числа комплексоутворювача. Внутрішню координаційну сферу позначають у квадратних дужках. Наприклад, у комплексній солі 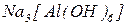 внутрішня координаційна сфера -
внутрішня координаційна сфера -  , у
, у 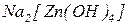 -
-  .
.
Зовнішня координаційна сфера – це катіони або аніони (протиіони), які компенсують заряд внутрішньої координаційної сфери, щоб речовина загалом була електронейтральною. Наприклад, у комплексних солях 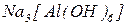 та
та 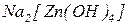 протиіонами є катіони
протиіонами є катіони 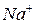 .
.
Приклади складання формул комплексних солей:
а. Скласти формулу комплексної солі, яка утворюється під час реакції гідроксиду хрому (ІІІ) з гідроксидом калію (координаційне число комплексоутворювача дорівнює 6).
Комплексоутворювач - 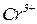 , координаційне число – 6; ліганди -
, координаційне число – 6; ліганди - 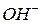 , монодентатні; отже склад внутрішньої координаційної сфери -
, монодентатні; отже склад внутрішньої координаційної сфери - 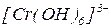 . Оскільки заряд внутрішньої координаційної сфери -3, компенсуємо трьома іонами
. Оскільки заряд внутрішньої координаційної сфери -3, компенсуємо трьома іонами 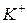 . Рівняння заданої реакції
. Рівняння заданої реакції
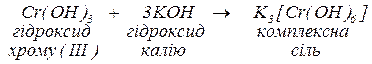
б. Скласти формулу комплексної солі, яка утворюється під час реакції гідроксиду стануму (ІІ) з гідроксидом натрію (координаційне число комплексоутворювача дорівнює 4).
Комплексоутворювач - 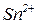 , координаційне число – 4; ліганди -
, координаційне число – 4; ліганди - 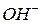 , монодентатні; отже склад внутрішньої координаційної сфери -
, монодентатні; отже склад внутрішньої координаційної сфери - 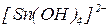 . Оскільки заряд внутрішньої координаційної сфери -2, компенсуємо двома іонами
. Оскільки заряд внутрішньої координаційної сфери -2, компенсуємо двома іонами 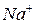 . Рівняння заданої реакції
. Рівняння заданої реакції
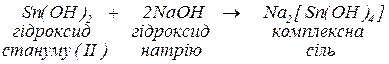
Комплексні солі реагують:
1. з кислотами з утворенням середніх солей, якщо кислоту взято у надлишку:
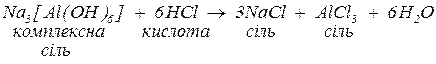
2. за нестачі кислоти може утворитися або суміш основної та середньої солі, або (найчастіше) осад гідроксиду та середня сіль. В обох випадках середня сіль утворюється з іонів зовнішньої сфери.
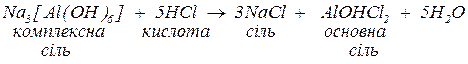
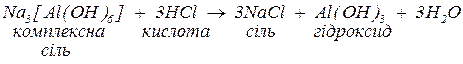
Date: 2015-09-05; view: 1430; Нарушение авторских прав