
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гальванический элемент
|
|
Гальванический элемент – это устройство, способное преобразовывать свободную энергию Гиббса окислительно-восстановительной реакции в электрическую.
Элемент состоит из двух электродов (например, цинк и медь), опущенных в растворы собственных солей (или другого электролита) и соединенных проводником.
Растворы солей также приведены в электрический контакт полупроницаемой мембраной или электролитическим ключом в виде стеклянной трубки, заполненной насыщенным раствором КСl.
При этом через проводник протекает электронный ток, а на электродах в растворе электролита протекают окислительно-восстановительные реакции. На внутреннем участке электрической цепи гальванического элемента (растворы солей и насыщенный раствор КСl) протекает ионный ток.
Например, для элемента Даниэля-Якоби:
– на аноде Zn0-2e=Zn2+ – окисление;
– на катоде Cu2+ +2e=Cu 0 – восстановление.
Уравнение токообразующей реакции:
Zn0+ Cu2+ =Zn2+ +Cu0.
Схема гальванического элемента: 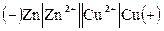 .
.
Электродвижущая сила (ЭДС) гальванического элемента (ε) выражается разностью установившихся электродных потенциалов катода и анода:
ε =ЕК-ЕА.
При стандартных условиях (при погружении металла в раствор собственного иона с одномоляльной концентрацией при температуре Т=25°С), электродный потенциал металла равен его стандартному электродному потенциалу (прил. 6).
В условиях, отличающихся от стандартных, электродный потенциал металла (Е) зависит от концентрации его ионов в растворе (при постоянной температуре), что выражается уравнением Нернста:
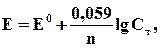
где Е0- стандартный электродный потенциал, В; n – число электронов, принимающих участие в процессе (заряд иона); Сm – моляльная концентрация (активность) гидратированных ионов металла в растворе, моль/кг Н2О.
Пример 1. Составьте схемы двух гальванических элементов, в одном из которых металл был бы катодом, а в другом – анодом. Напишите уравнения реакций, протекающих на электродах в гальванических элементах. Определите ЭДС элементов при температуре 298 К, если активность ионов обоих металлов в первом элементе равна 0,01 моль/кг Н2О, а в другом 1,0 моль/кг Н2О.
Решение. Металл – медь. Составим элемент, в котором медный электрод является катодом. Анодом можно выбрать любой металл, имеющий меньший электродный потенциал, например – магний.
Схема гальванического элемента: (-) Mg/ Mg2+//Cu2+/Cu (+).
Реакция на аноде: Mg(тв.)-2e=Mg2+(водн.)
Реакция на катоде: Cu2+(водн.) +2e=Cu(тв.)
Уравнение токообразующей реакции:
Mg(тв.) + Cu2+(водн.) =Mg2+(водн.) +Cu(тв.)
Значения потенциалов электродов рассчитаем по уравнению Нернста:
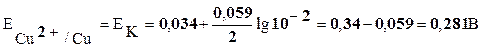 ,
,
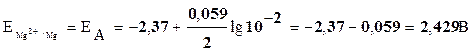 ,
,

Составим элемент, в котором медный электрод является анодом. Катодом можно выбрать любой металл, имеющий больший электродный потенциал, например, ртуть:
(-)Cu / Cu 2+//Hg2+/ Hg (+).
Запишем уравнение реакций:
Cu(тв.)-2e=Cu2+(водн.) – на аноде;
Hg2+(водн.) +2e=Hg(ж.) – на катоде.
Суммарное уравнение:
Cu(тв.)+ Hg2+(водн.) =Cu2+(водн.) + Hg(ж.).
Так как активность ионов металла в растворах равна 1 моль/кг воды, то в данном элементе оба значения потенциалов – стандартные:
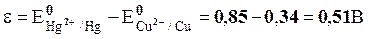 .
.
Ответ: ε=0,51 В.
Date: 2015-09-18; view: 569; Нарушение авторских прав