
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Комплексные соединения
|
|
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называются комплексными. Строение комплексных соединений объясняет координационная теория. В комплексных соединениях различают внешнюю и внутреннюю (комплексный ион) сферы. Во внутренней сфере комплексных соединений:
1) центральное место занимает комплексообразователь – обычно положительно заряженный ион;
2) вокруг комплексообразователя расположены или координированы лиганды (адденды), т.е. ионы противоположного знака или нейтральные молекулы;
3) находится координационное число, показывающее, сколько лигандов удерживает комплексообразователь.
Во внешнюю сферу входят катионы или анионы. Комплексные соединения – неэлектролиты не имеют внешней сферы, например, [Pt(NH3)2Cl4]. Типичными комплексообразователями являются d-элементы: Ag+, Au+, Cu+, Cu2+, Hg2+, Cd2+, Zn2+, Fe2+, Fe3+, Co2+, Ni2+, Pt4+ и другие, а также s,p – элементы (Ве, Al, Sn, Pb). Важнейшими лигандами являются:
1) нейтральные молекулы, имеющие дипольный момент: Н2О, NН3, СО, NО и другие;
2) ионы СN-, NО2-, Сl-, Br-, J-, S2O32-, ОН-, СО32- и другие.
Значения координационного числа (КЧ) для некоторых ионов комплексообразователей приведены в таблице:
| КЧ=2 | КЧ=4 | КЧ=6 | КЧ=8 |
| Ag+, Au+, Cu+ | Cu2+, Hg2+, Cd2+, Ве2+, Al3+, Pt2+ | Zn2+, Fe2+, Fe3+, Co2+, Ni2+, Pt4+, Сr3+ | Cа2+, Ва2+, Sr2+, Ti4+ |
Как видно, чаще всего координационное число имеет значения 4 и 6. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. При этом заряд комплексообразователя принимается равным его степени окисления. Вследствие того, что любое комплексное соединение в целом электронейтрально, алгебраическая сумма зарядов внешней и внутренней сфер комплексного соединения равна нулю.
Пример 1. Вычислить заряды следующих комплексных ионов, образованных хромом (III): а) [CrCl(H2O)5]; б) [CrCl2(H2O)4]; в) [Cr(C2О4)2(H2O)2].
Решение. Заряд иона хрома (III) принимаем равным +3, заряд молекулы воды равен нулю, заряды хлорид- и оксалат-ионов соответственно равны -1 и -2. Составляем алгебраические суммы зарядов для каждого из указанных соединений: а) +3 + (-1) =+2; б) +3 +2(-1) = +1; в) +3 +2(-2) = -1.
Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже. Название комплексного катиона составляют следующим образом: сначала указывают числа (используя греческие числительные: ди, три, тетра, пента, гекса и т.д.) и названия нейтральных лигандов, причем вода называется аква, а аммиак – аммин. Затем указывают числа и названия отрицательно заряженных лигандов с окончанием «о» (Cl- - хлоро, SO42- - сульфато, ОН- - гидроксо и т.д.); последним называют комплексообразователь, указывая его степень окисления (в скобках римскими цифрами после названия комплексообразователя).
Пример 2. Назвать комплексные соли: [PtCl(NH3)3]Cl, [СоBr(NH3)5]SO4, Ва[Сr(SСN)4(NH3)2].
Решение. [PtCl(NH3)3]Cl – хлорид триамминхлороплатины (II); [СоBr(NH3)5]SO4 – сульфат пентамминбромокобальта (III); Ва[Сr(SСN)4(NH3)2] –диамминтетрароданохромат (III) бария.
В водных растворах комплексные соли диссоциируют в две стадии. Внешнесферная диссоциация комплексных солей происходит практически полностью с образованием комплекных ионов и ионов внешней сферы. Эта диссоциация называется первичной. Комплексные ионы, в свою очередь, под воздействием дополнительных внешних факторов, подвергаются вторичной диссоциации на центральный ион и лиганды. Вторичная диссоциация протекает незначительно и характеризуется константой равновесия, называемой константой нестойкости комплексного иона. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Пример 3. Написать уравнения первичной и вторичной диссоциации комплексной соли [Ag(NH3)2]Cl. Составить выражение для константы нестойкости комплексного иона.
Решение. Первичная диссоциация протекает согласно уравнению:
[Ag(NH3)2 ] Cl→ [Ag(NH3)2]+ + Cl-
Комплексный ион, в свою очередь, подвергается вторичной диссоциации на центральный ион и лиганды: [Ag(NH3)2]+↔ Ag+ +2 NH3. Составим выражение для константы нестойкости комплексного иона:
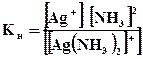 .
.
Date: 2015-09-18; view: 735; Нарушение авторских прав