
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
|
|
Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Степень окисления – это условный заряд атома в молекуле, возникающий вследствие разности электроотрицательностей и рассчитанный из предположения, что молекула состоит только из ионов. Окисление – это процесс отдачи электронов, который приводит к повышению степени окисления восстановителя. Восстановление – это процесс присоединения электронов, при котором понижается степень окисления у окислителя. При определении степени окисления атомов необходимо помнить:
- что степень окисления атома в молекуле простого вещества равна нулю;
- степень окисления атома водорода во всех соединениях, кроме гидридов щелочных и щелочноземельных металлов равна +1;
- степень окисления кислорода во всех соединениях, кроме пероксидных и ОF2, равна –2;
- сумма степеней окисления всех атомов в молекуле равна нулю.
Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2–); атом элемента, находящийся в промежуточной степени окисления, может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4–). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования.
Пример 1. Могут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и HI; б) H2S и H2SО3; в) H2SО3 и HClО4?
Решение: а) степень окисления серы в H2S равна –2, йода в HI равна –1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) степень окисления серы в H2S равна –2, то есть низшая, в H2SО3 –равна +4 – промежуточная. Следовательно, взаимодействие этих веществ возможно, причем H2SО3 является окислителем;
в) степень окисления серы в H2SО3равна +4 (промежуточная), хлора в HClО4 равна +7 (высшая). Соединения H2SО3 и HClО4 могут реагировать, причем H2SО 3 будет проявлять восстановительные свойства.
Пример 2. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах:
KNO2+KI+H2SO4®J2+NO + …`
Решение. В реакции йод меняет степень окисления от –1 в иодиде калия до нуля в I2. Йод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит-ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:
 
|
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится, если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ, образуют соли с серной кислотой:
2KNO2+2KI+2H2SO4®J2+2NO +2 К2SO4+2 H2O
Пример 3. Установить, в каком направлении возможно самопроизвольное протекание реакции 2NaCl+Fe2(SO4)3=2FeSO4+Cl2+Na2SO4?
Решение. Уравнение реакции в ионно-молекулярной форме:
2Cl-+2Fe3+=2Fe2++Cl2
Запишем стандартные электродные потенциалы электрохимических систем, участвующих в реакции, используя данные прил. 6:
Cl2+2e-=2Cl- E1=1,36 B
Fe3++e-=Fe2+ E2=0,77 B
Поскольку Е1 >Е2, то окислителем будет служить хлор, а восстановителем – ион Fe2+; рассматриваемая реакция будет протекать справа налево.
Пример 4. Найти при 25°С константу равновесия реакции Hg2(NO3)2+2Fe(NO3)2=2Hg+2Fe(NO3)3.
Решение. Уравнение реакции в ионно-молекулярной форме:
Hg22++2e-=2Hg+2Fe3+
В реакции участвуют две электрохимические системы (прил. 6):
Hg22++2e-=2Hg - E1=0,79 В
Fe3++e-=Fe2+ E2=0,77 B
Находим значение стандартной ЭДС рассматриваемого элемента:
E0=E1-E2=0,79-0,77=0,02 В.
Теперь вычислим константу равновесия реакции:
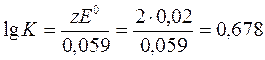 , К=4,76.
, К=4,76.
Ответ: К=4,76.
Date: 2015-09-18; view: 591; Нарушение авторских прав