
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ионное произведение воды. Водородный показатель
|
|
Вода является слабым электролитом и диссоциирует по уравнению
Н2О↔ Н+ + ОН-
Константа диссоциации воды весьма мала и составляет при 25ºC:

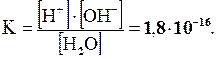
Принимая концентрацию воды [Н2О] величиной практически постоянной и учитывая, что молярная концентрация воды в воде равна 1000/18 =
=55,56 моль/л, получаем
[Н+] ·[ОН-] = 1·10-14 = Кн2о.
Произведение концентрации ионов водорода и гидроксила называется ионным произведением воды. Поскольку диссоциация воды – эндотермический процесс, то с ростом температуры она увеличивается, и значение Кн2о возрастает.
Так как при диссоциации одной молекулы воды получается один ион водорода и один ион гидроксила, то в чистой воде [Н+] = [ОН-] = 10-7моль/л (при 25ºC). Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными.
Если к воде прибавить кислоту, то [Н+]>10-7моль/л; а если прибавить щелочь, то [Н+]<10-7моль/л.
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком.
Отрицательный десятичный логарифм концентрации водородных ионов принято называть водородным показателем рН:
рН = -lg [Н+].
Тогда рН различных растворов будут иметь следующие значения: кислый рН < 7, нейтральный рН=7, щелочной рН > 7.
Отрицательный десятичный логарифм концентрации гидроксид-ионов принято называть гидроксильным показателем рОН:
рОН = -lg [ОН-].
При 25ºC рН + рОН = 14.
Пример 1. Концентрация ионов водорода в растворе равна
4·10-4 моль/дм3. Определить рН раствора.
Решение. Округляя значение логарифма до 0,01, получим
рН = -lg [4·10-4] = - (-2,40) = 2,40.
Пример 2. Чему равнаконцентрация гидроксид-ионов в растворе, рН которого равен 10,80?
Решение. Из соотношения рН + рОН = 14, находим: рОН = 14-рН =14-10,80 = 3,20. Отсюда lg [ОН-] =- 3,20. Этому значению логарифма соответствует значение [ОН-] =6,31·10-4 моль/дм3.
Date: 2015-09-18; view: 732; Нарушение авторских прав