
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типи аутосомного успадкування
|
|
| Критерії порівняння | Тип успадкування | |
| Аутосомно-домінантний | Аутосомно-рецесивний | |
| Локалізація гена | аутосома | |
| Стан гена | домінантний | рецесивний |
| Закони успадкування | Менделя | |
| Які статі хворіють | чоловіча і жіноча | |
| Результати прямого і зворотного схрещування | однакові | |
| Проявляється у генотипі | гомозиготному домінантному (АА) гетерозиготному (Аа) | гомозиготному рецесивному (аа) |
| Поширеність у популяціях | низька | висока |
| Причини поширеності | у більшості випадків тварини не залишають нащадків, тобто відбувається елімінація таких генів | ген постійно перебуває у гетерозиготному стані і проявляється у нащадків від гетерозиготних батьків |
| Ризик підвищення частоти | є у популяціях, де спостерігається родинне парування – інбридинг |
Типи Х-зчепленого успадкування*
| Критерії порівняння | Х-зчеплений-домінантний | Х-зчеплений-рецесивний |
| Локалізація гена | Х-хромосома | |
| Для кого характерний | для всіх видів тварин, у яких є гетерогаметна стать | |
| Які статі можуть хворіти | чоловіча і жіноча | |
| Яка стать хворіє частіше | чоловіча | |
| Сини успадковують | від матері | |
| Дочки успадковують | від батька | |
| Результати прямого і зворотного схрещування | різний | |
| Стан гена | домінантний | рецесивний |
| Проявляється у генотипі | у самок – гомозиготному домінантному (АА), гетерозиготному (Аа); у самців – гемізиготному (АY чи А0) | у самок – гомозиготному рецесивному (аа); у самців – гемізиготному (аY чи а0) |
| Поширеність | низька | висока |
| Причини поширеності | у більшості випадків тварини не залишають нащадків, тобто відбувається елімінація таких генів | ген постійно перебуває у прихованому гетерозиготному стані і часто проявляється у нащадків |
| Ризик підвищення частоти | у популяціях, де спостерігається родинне парування – інбридинг | |
| Хворий син | мати хвора гомо- чи гетерозиготна, батько хворий чи здоровий | мати хвора або носій аномалії, батько хворий чи здоровий |
| Хвора дочка | батько хворий, мати хвора (гомо- чи гетерозиготна) чи здорова | батько хворий, мати хвора або носій |
| Мати гомозиготна здорова і здоровий батько | усі діти здорові | |
| Мати гомозиготна хвора і хворий батько | усі діти хворі | |
| Мати гомозиготна хвора, батько – здоровий | всі діти хворі | всі сини хворі, всі дочки здорові носії |
| Мати гомозиготна здорова, батько – хворий | усі сини здорові, всі дочки хворі | всі діти здорові, 50% дочок носії |
| Мати гетерозиготна, батько – хворий | 50% синів та всі дочки хворі | 50 % синів і дочок хворі, інші 50 % дочок – носії |
| Мати гетерозиготна, а батько – здоровий | 50% дочок хворих, 50% синів хворих | 50 % синів хворі, всі дочки здорові з яких 50% носії |
*характерний для видів тварин, у яких гетерогаметною статтю є чоловіча
Типи Z -зчепленого успадкування*
| Критерії порівняння | Z -зчеплений-домінантний | Z -зчеплений-рецесивний |
| Локалізація гена | Z-хромосома | |
| Для кого характерний | для всіх видів тварин, у яких є гетерогаметна стать | |
| Які статі можуть хворіти | чоловіча і жіноча | |
| Яка стать хворіє частіше | жіноча | |
| Сини успадковують | від матері | |
| Дочки успадковують | від батька | |
| Результати прямого і зворотного схрещування | різний | |
| Стан гена | домінантний | рецесивний |
| Проявляється у генотипі | у самців – гомозиготному домінантному (АА) та гетерозиготному (Аа); у самок – гемізиготному (АY чи А0) | у самців – гомозиготному рецесивному (аа); у самок – гемізиготному (аY чи а0) |
| Поширеність | низька | висока |
| Причини поширеності | у більшості випадків тварини не залишають нащадків, тобто відбувається елімінація таких генів | ген постійно перебуває у прихованому гетерозиготному стані і часто проявляється у нащадків |
| Ризик підвищення частоти | у популяціях, де спостерігається родинне парування – інбридинг | |
| Хворий син | батько хворий гомо- чи гетерозиготний, мати хвора | батько хворий, або гетерозиготний носій, мати хвора |
| Хвора дочка | батько хворий гомо- чи гетерозиготний, мати хвора чи здорова | батько хворий чи гетерозиготний носій, мати хвора чи здорова |
| Батько гомозиготний здоровий і здорова мати | усі діти здорові | |
| Батько гомозиготний хворий і хвора мати | усі діти хворі | |
| Батько гомозиготний хворий, мати – здорова | всі діти хворі | всі дочки хворі, всі сини здорові носії |
| Батько гомозиготний здоровий, мати – хвора | всі сини хворі, всі дочки здорові | всі діти здорові, всі сини здорові носії |
| Батько гетерозиготний, мати – хвора | всі сини хворі, 50% дочок хворих | 50% дочок хворих, 50% синів хворих, 50% синів здорові носії |
| Батько гетерозиготний, а мати – здорова | 50% дочок хворих, 50% синів хворих | 50% дочок хворих, усі сини здорові, 50% синів здорові носії |
*характерний для видів тварин, у яких гетерогаметною статтю є жіноча
Голандричний та голагенічний типи успадкування
| Критерії порівняння | Голандричний | Голагенічний |
| Локалізація гена | Y-хромосоми | W-хромосоми |
| Поширеність | надзвичайно низька | |
| Для яких таксонів характерний | у яких гетерогаметною є чоловіча стать (ссавці, ракоподібні, черв’яки, комахи ряду двокрилих, більшість амфібій, деякі риби) | у яких гетерогаметною є жіноча стать (птахи, плазуни, деякі риби, метелики) |
| Ким передається | виключно від батька | виключно від матері |
| Кому передається | усім синам | усім дочкам |
| Якщо хворий батько | всі сини хворі | – |
| Якщо хвора мати | – | усі дочки хворі |
Гомологічний тип успадкування
Аномалії, які визначаються цими генами, успадковуються за законами Менделя.
Залежний від статі типи успадкування
Аномалії, які визначаються цими генами, успадковуються за законами Менделя, але проявляються у особин певної статі.
4. Летальні гени та їх практичне використання у тваринництві
Летальні гени − це гени, які викликають загибель організму до досягнення ним статевої зрілості.
Дія летальних генів може проявлятися на будь-якій стадії онтогенезу, однак найчастіше у ембріональний період або відразу після народження.
Класифікація генів за ступенем їх пенетрантності та експресивності:
Ø летальні – викликають смертність у 90-100 % носіїв;
Ø напівлетальні (сублетальні) – викликають смертність у 50-90% носіїв;
Ø субвітальні – зумовлюють зниження життєздатності на 10-50% у 1-50% носіїв.
Летальні гени намагаються елімінувати з популяцій домашніх тварин.
Іноді гетерозиготних тварин-носіїв летальних генів не вибраковують, тому що вони мають бажану господарсько-корисну ознаку.
Летальні гени успадковують за типом плейотропії, для якої характерне зрушення типового розщеплення з 3: 1 до 2: 1.
У лисиць відомий домінантний ген, який у гетерозиготних особин визначає платинове забарвлення хутра. У гомозиготному стані він зумовлює загибель зигот на ранніх етапах ембріонального розвитку. Так, при схрещуванні платинових лисиць між собою 25 % особин, які мають гомозиготний домінантний генотип, гинуть у період ембріонального розвитку:
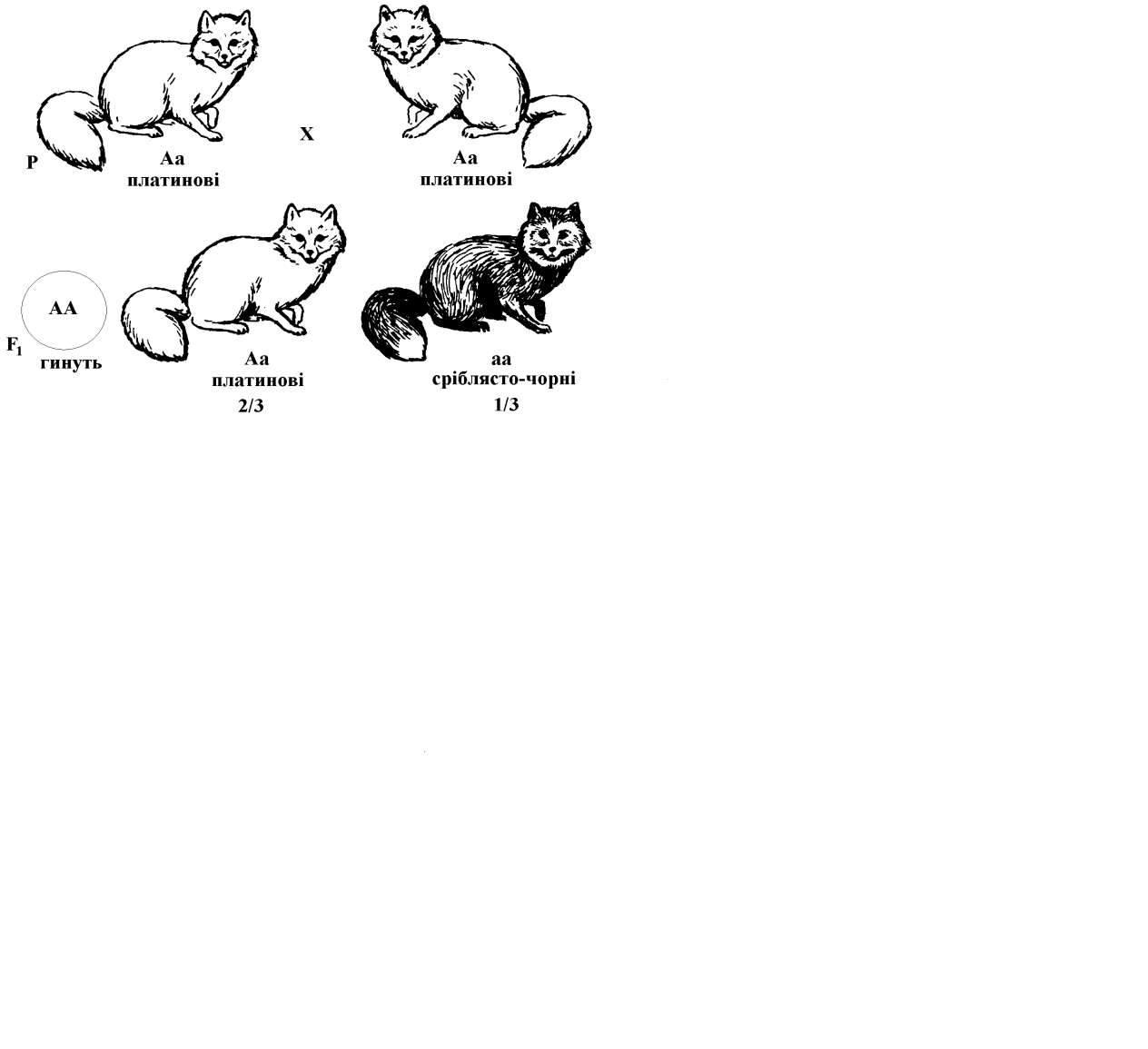
|
Щоб уникнути загибелі тварин та отримати платинових схрещують платинових (Аа) зі сріблясто-чорними (аа):

|
Використання летальних генів у тваринництві
| Вид, порода | Селективна перевага гетерозигот | Результат гомозиготності |
| Коні, різні породи | Альбінізм | Рання ембріональна смертність |
| Велика рогата худоба | Тип Декстер | Бульдогоподібні телята, які абортують |
| Вівці, каракульська | Сіре забарвлення | Розлад травлення та ювенільна смертність |
| Лисиця, платинова | Освітлення пігментації | Ембріональна смертність |
| Норка, хеггедальська | Освітлення пігментації | Ембріональна смертність |
| Кури, нью-гемпшир | Гіпертрофія м’язів | Атрофія м’язів |
5. Спадкові хвороби обміну речовин тварин та людини
Спадкові хвороби обміну речовин (молекулярні хвороби, ферментопатії, ензимопатії) − хвороби, які виникати на рівні передачі генетичної інформації, обумовлюючи порушення обміну речовин через відсутність певних ферментів.
Деякі хвороби обміну речовин тварин і людини
| Назва та тип успадкування | Причини | Симптоми | Діагностика | Лікування та попередження прояву |
| Алькаптонурія у людини (аут.-рец.) | Порушення окислення гомогентизинової кислоти через нестачу ферменту оксидази гемогентизинової кислоти. | Переродження хрящів, захворювання серця і судин, атеросклероз. | При додаванні до сечі лугу вона темнішає, а при добавлянні кислоти або вітаміну С – не темнішає. | Великі дози вітаміну С. |
| Фенілкетонурія у людини (аут.-рец.) | Відсутність ферменту фенілаланінгідроксилази, який перетворює амінокислоту фенілаланін на тирозин (джерело тироксину, адреналіну, меланіну тощо). | У тканинах накопичується велика кількість проміжних продуктів розщеплення, так званих кетокислот (фенілацетат, фенілтруват, фенілактат), які є токсичними продуктами для нервової системи, що призводить до різного степеня розумової відсталості у дітей. Гетерозиготні носії (10 до 30 % з них) страждають старечою недоумкуватістю. | За допомогою реактиву Фелінга, який при додаванні до свіжої сечі набуває синьо-зеленого кольору. Гетерозиготних носіїв виявляють добавляючи в їжу фенілаланін (з розрахунку 0,1 г на 1 кг живої маси) з наступним визначенням концентрації його в крові. У здорових людей концентрація фенілаланіну за першу годину зростає в 4-5, а в гетерозиготних носіїв – в 10 і більше разів. | Дієта з вилученням з продуктів харчування амінокислоти фенілаланін, що попереджає прояв хвороби. |
| Альбінізм у людини і тварин (місцевий – аут.-дом.; загальний − аут.рец.) | Відсутність ферменту тирозинази, який перетворює тирозин на меланін. | Меланін відсутній у шкірі, волоссі, райдужній оболонці, що спричинює світлобоязнь, зниження гостроти зору, ністагм, глухоту з німотою, епілепсію, а також запалення шкіри при сонячному опромінюванні. Місцевий альбінізм − відсутність меланіну у шкірі і волоссі Загальний альбінізм − відсутність меланіну у шкірі, волоссі та райдужній оболонці очей (червоні осі). | − | Методів лікування немає. Уникнення ультрафіолетового опромінення попереджає опіки на шкірі. |
| Порфирія (у овець, у великої рогатої худоби − шортгорни, голштинофризи, ямайська чорна і червона − аут.-рец.) (у свиней − аут.-дом.) | Надлишкове накопичення порфірину (компонент гемоглобіну) у крові, кістках зубах та інших частинах тіла через ферментну блокаду метаболізму при утворенні гему – небілкової частини гемоглобіну з попередника профобіліногену. | Червонувато-коричнева сеча і рожеве забарвлення зубів; перебування на сонці викликає опіки шкіри, які перетворюються на глибокі виразки (найчастіше навколо очей, ніздрів, уздовж спини, де шкіра не захищена волоссям, а також на ділянках шкіри з білим волоссям), а після заживання − у рубці. | _ | Якщо тварину не випускати на сонце, хвороба не виявляється. |
| Надлишкове накопичення філлоеритрину в овець (саутдаунські вівці) (аут.-рец.) | Різновид порфирії | Виявляється у 5-7-тижневому віці, коли ягнята починають поїдати зелений корм на пасовищі. Печінка ягнят не може виділяти філлоеритрин, який утворюється при розщепленні хлорофілу, і під дією сонячного випромінювання на лицьовій частині голови і вухах виникає екзема, а через 2-3 тижні після виникнення перших ознак хвороби настає смерть. | − | − |
6. Клініко-генеалогічний метод дослідження
Одним із методів вивчення спадкових аномалій у сільськогосподарських тварин є гібридологічний аналіз. Але його можна використати лише для тварин, які швидко розмножуються (птахи, кролі). Для тварин малоплідних і таких, які повільно розмножуються, використовують клініко-генеалогічний метод.
Завдяки цьому методу можна встановити спадкову природу аномалії, її тип успадкування, рівень пенентрантності та експресивності генів, наявність їх зчеплення, розшифрувати механізм взаємодії генів, вивчити інтенсивність мутаційного процесу тощо.
Технічно клініко-генеалогічний метод складається з двох етапів: складання родоводу та його генетичного аналізу.
| Перший етап: складання родову При складанні родоводу користуються міжнародною системою умовних позначень у людини. Жіночу стать позначають кружечком, чоловічу – квадратом. При складанні схем схрещувань, як правило, ліворуч розміщують чоловічу особину, праворуч – жіночу. Покоління нумерують римськими цифрами (І, ІІ, ІІІ і т.д.). У кожному поколінні нащадків нумерують арабськими цифрами зліва направо. Особини з аномаліями позначаються зафарбованими символами. Особина, успадкування аномалії у якої ми хочемо прослідкувати, називається пробандом. Дітей однієї батьківської пари (рідних братів та сестер) називають сибсами. Другий етап: генетичний аналіз Після складення родоводу проводять його генетичний аналіз. Якщо у родоводі зустрічається одна і та ж аномалія у декількох особин у різних поколіннях, то можна зробити висновок про те, що вона спадкова. Тип її успадкування можна встановити, знаючи особливості успадкування генів та типи родоводів (табл.). | Умовні позначення, які застосовуються
при складанні родоводу

|
Таблиця. Типи родоводів
| Тип | Приклад родоводу | Пробанд | Сибси | Батьки | Сибси батьків | На який тип успадкування вказує |
| 1. | хвора особина чоловічої або жіночої статі | 1) здорові; 2) хворий хоча б один | здорові | здорові | аутосомно-рецесивний | |
| 2. | аборт, або мертвонароджені особини чоловічої і жіночої статі | 1) здорові; 2) абортовані; 3)мертвонароджені | здорові | – | аутосомно-рецесивна летальна аномалія | |
| 3. | хвора особина чоловічої або жіночої статі | 1) здорові; 2) хворий хоча б один | хворий один із батьків | – | аутосомно-домінантний | |
| 4. | хвора особина чоловічої або жіночої статі | здорові | здорові | хворий хоча б один | аутосомно-неповно домінантний | |
| 5. | хвора особина чоловічої статі | 1) брати здорові; 2)один із братів хворий; 3) всі брати хворі | здорові | – | Х-зчеплений рецесивний | |
| 6. | хвора особина чоловічої статі | усі брати хворі | хворий батько | хворі брати | голандричний |
7. Хромосомні хвороби тварин і людини.
Хромосомні хвороби обумовлені хромосомними мутаціями.
Хромосомні мутації (аберації) − зміна двох або декількох генів, що призводить до зміни форми хромосом.
Хромосомні хвороби тварин і людини
| Назва | Причина | Симптоми |
| Транслокації Робертсона (ВРХ і ДРХ, собаки і миші) | Злиття двох акроцентричних хромосоми в одну метацентричну, як наслідок 59 хромосом замість 60. | У ВРХ − порушення плодючості і лейкоз; у кіз – інтерсексуальність; у овець – гіпоплазія гонад і стерильність; У собак – хондродистрофія, розщеплення верхньої губи і вади серця; у мишей – множинні аномалії. |
| Інтерхромосомна транслокація 1/29 у ВРХ | Вклинення фрагменту однієї хромосоми в іншу. | Тварини фенотипово нормальні і з нормальною плодючістю. Проте здатність їх нащадків до запліднення низька, а смертність ембріонів на різних стадіях розвитку сягає 4 %. |
| Транслокація 4/14 у свиней | Вклинення фрагменту однієї хромосоми в іншу. | Зниження здатності до запліднення на 56 % при нормальній якості сперми. |
| Хронічний мієлоз у людини | Філадельфійська хромосома, яка утворюється у результаті делеції великої частини 21 хромосоми. | Важка форма білокрів’я, яка характеризується невпинним розмноження деяких видів лейкоцитів. Така хромосома може виникати у деяких клітинах дорослого організму. |
Всі без винятку хромосомні аберації утруднюють кон'югацію не зовсім гомологічних хромосом, а це призводить до зниження інтенсивності мейозу і кількості гамет, тобто до зменшення плодючості.
8. Геномні хвороби людини
Геномні хвороби обумовлені геномними (плоїдними) мутаціями.
Геномні (плоїдні) мутації − збільшення або зменшенням кількості хромосом у каріотипі організму.
Хромосомні хвороби людини, обумовлені аутосомними анеуплоїдіями
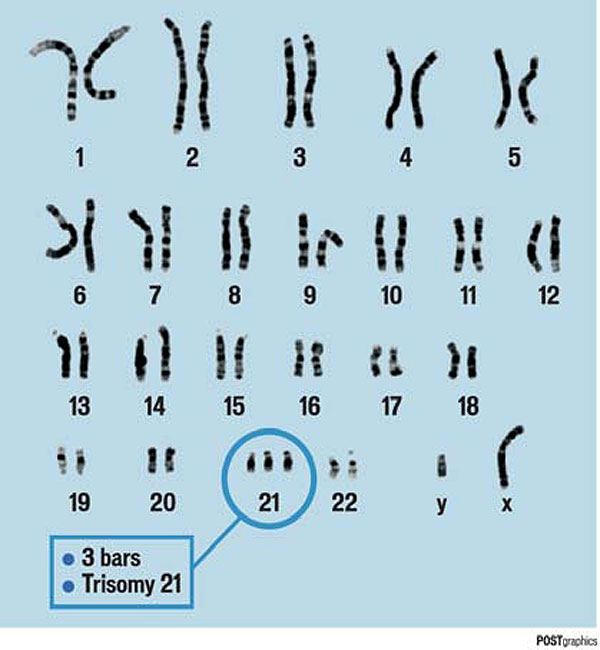
Синдром Дауна (трисомія 21)
Вади розвитку внутрішніх органів, низький зріст, зменшена голова, обличчя приплюснуте, розкосі очі (епікант), одна складка на лодоні, викривлення мізинця на руці, аномальна відстань мі ж 1 та 2 пальцями на нозі, різна ступінь розумової відсталості (від легкої недоумкуватості до тяжкої форми ідіотизму).
Тривалість життя – до 30-ти років.
| 

|
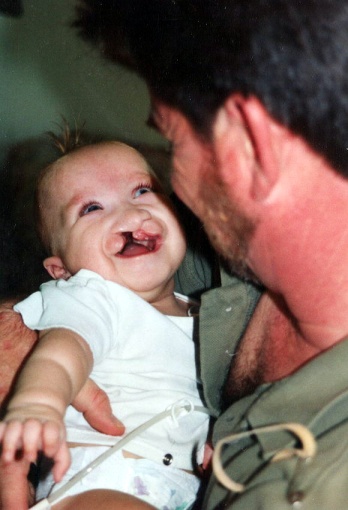
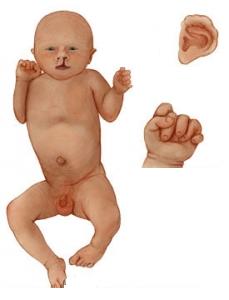
Синдром Патау (трисомія хромосом групи D − 13,14,15)
Вади розвитку внутрішніх органів, «вовча паща», широко посаджені очі, запале перенісся, деформовані й низько розміщені вушні раковини.
Тривалість життя – до 3 місяця.
| 
|
| Синдром Едварда (трисомія хромосом групи Е − 16,17,18) Вади розвитку внутрішніх органів, малий зріст, широкий лоб, недорозвинена нижня щелепа, маленький трикутної форми рот, деформовані вушні раковини і кисті рук, укорочені пальці, рухома шкіра, яка утворює складки. Тривалість життя – до 1 року. |  
|
| Трисомія № 8 (трисомія 8) Косоокість, короткопалість, дефекти у будові нігтів, збільшені вуха та ніс, помірна розумова відсталість. | |
| Анеуполоїдії у групах хромом А, В, С, О та ін Такі особини мають значні вади розвитку, які не сумісні з життям, тому абортують. |
Відомостей про аутосомних анеуплоїдів у тварин зовсім мало. Мабуть це пояснюється довільно абортованими нежиттєздатними плодами.
Аутосомна трисомія описана у 18 чи 19 парі хромосом у великої рогатої худоби, що зумовлює вкорочення кісток верхньої щелепи і вроджену черевну водянку (асцит). Аутосомна трисомія-23 у великоїрогатої худоби зумовлює карликовість. При збільшенні кількості довільних абортів на різних стадіях ембріонального розвитку понижується відтворювальна функція тварин, що завдає економічних збитків сільському господарству.
Хромосомні хвороби людини, обумовлені гоносомними анеуплодіями
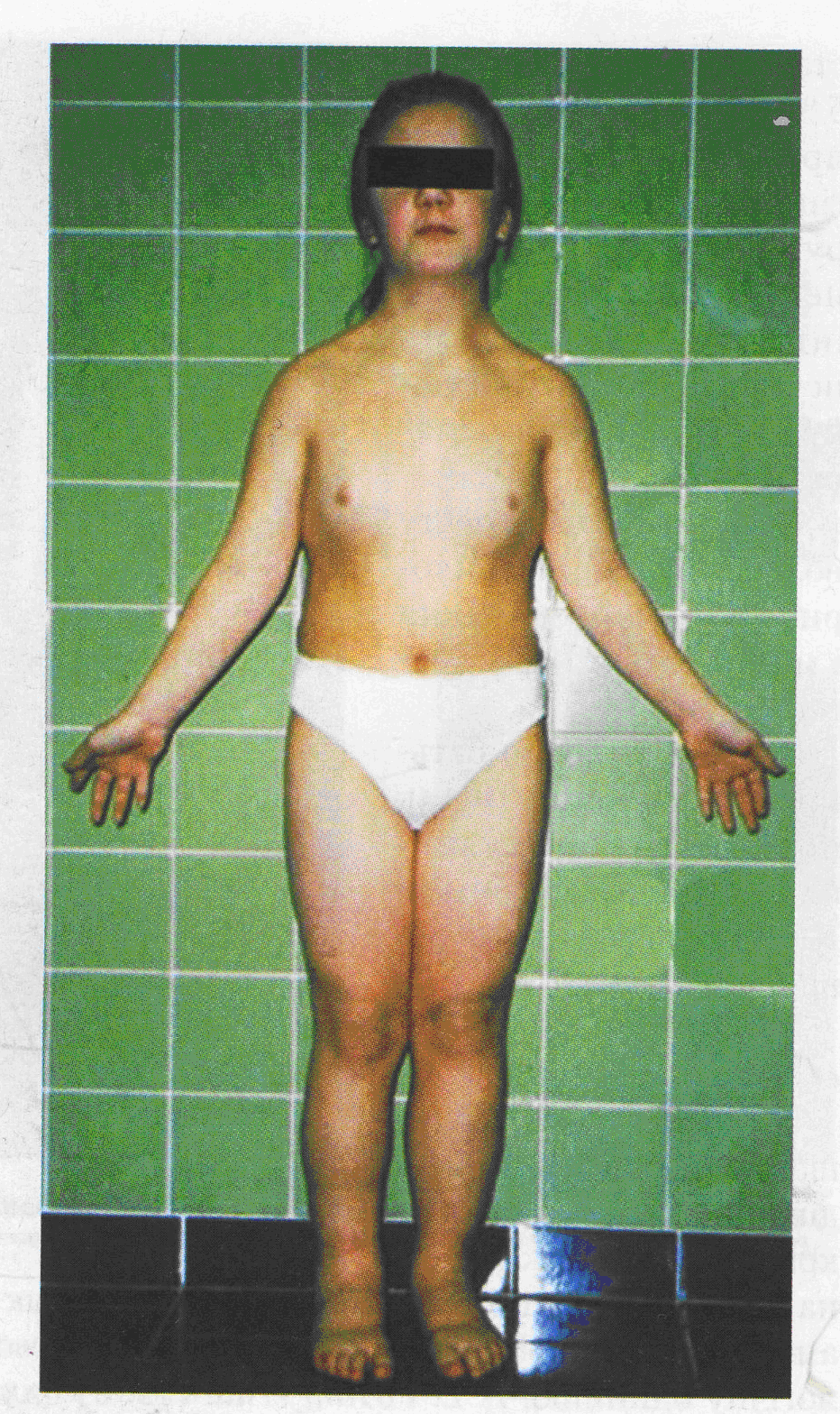
| Синдром Клайнфельтера (трисомія ХХY, ХХХY, ХХХХY) У чоловіків високий зріст та євнухоподібна будова тіла (недорозвинені гонади та вторинні статеві ознаки, безпліддя, порушення психіки, при важких формах – розумова відсталість. | Синдром Шерешевського-Тернера (моносомія Х0, або делеція, фрагментація однієї з Х-хромосом) У жінок малий зріст, недорозвинені статеві органи та вторинні статеві ознаки. Вушні раковини деформовані, розміщені низько, шия коротка, долоні широкі, зменшений четвертий палець, зменшений і викривлений п'ятий палець, нігті глибоко посаджені, ноги короткі і товсті. Стеноз аорти, легеневої артерії, гіпертонія, підковоподібна нирка тощо. Діти часто народжуються недоношеними. | ||
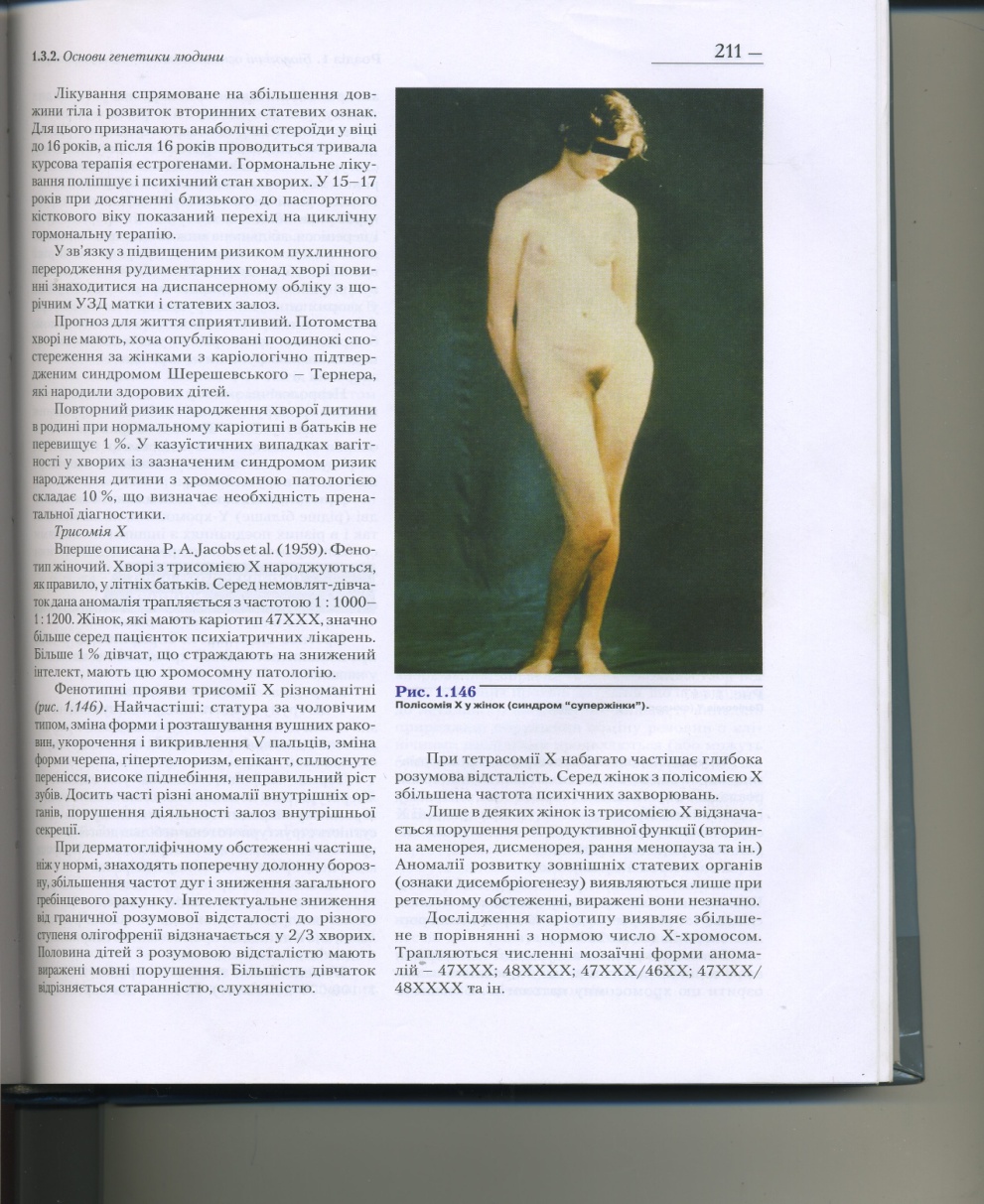
| Синдром трисомії за Х-хромосомою (трисомія ХХХ, ХХХХ, ХХХХХ) Зовні нормальна жінка середнього зросту, але з недорозвиненими внутрішніми статевими органами (іноді мають нормально розвинені статеві органи, тому здатні до дітонародження). Розумова відсталість, іноді шизофренія, депігментовані ділянки шкіри, біле пасмо волосся, аномалії скелета. Збільшення кількості Х-хромосом зумовлює більш тяжкий статевий інфантилізм і глибоку дебільність. | Синдром полісомії за Y-хромосомою (трисомія ХYY) Можливі два різко протилежні варіанти прояву синдрому за фенотипом. 1 варіант: чоловічий склад тіла, гіпогонадизм (зменшення статевих залоз), крипторхізм, розумова відсталість. 2 варіант: чоловічий склад тіла, високорослість, добре розвинута мускулатура, нормальний розвиток статевих залоз і ознак, великі вушні раковини і надбрівні дуги, кращий розвиток лицевого скелета порівняно з мозковим (образ рецидивіста). | ||

| 
| 
| 
|
| Синдром Клайнфельтера | Синдром полісомії за Y-хромосомою | Синдром Шерешевського-Тернера | Синдром трисомії за Х-хромосомою |
Синдром Клайнфельтера відомий у великої рогатої худоби, свиней, собак і котів
У великої рогатої худоби зумовлює порушення росту і розвитку самців (кастратний тип), різке зниження кількості сперматозоїдів (олігоспермія) і наявність мертвих сперматозоїдів (некроспермія) в еякуляті, зниження статевої потенції.
У свиней проявляється у вигляді тестикулярного гермафродитизму (ріст паренхіми яєчника у сім'яниках) з частковою появою у кнурців жіночих зовнішніх статевих органів.
У собак спостерігається уроджені вади серця, у котів – черепахова масть, безпліддя.
Причиною виникнення різних анеуплоїдів може бути нерозходження статевих хромосом при мейозі або втрата в анафазі однієї зі статевих хромосом. Це зумовлюють внутрішні (перебудови хромосом, старіння) та зовнішні (екологічні фактори) фактори.
9. Аномалії тварин і людини, обумовлені мозаїцизмом
Мозаїцизм, або химеризм – явище при якому організм складається з тканин з різними наборами хромосом.
Химери можна одержати штучно при пересадженні тканин у тварин і при щепленнях у рослин.
Гінадроморфізм − різновидність мозаїцизму за якого організм складаються зі сторін, які належать різним статям (ХХ та ХУ).
Причини виникнення гінадроморфів:
Ø соматична геномна мутація – втрата статевої хромосоми в одному з перших двох бластомерів зиготи;
Ø утворення в яйцеклітині двох ядер та запліднення їх різними сперматозоїдами (X і У) і подальший розвиток нащадка із двоядерної зиготи.

| Гінандроморф дрозофіли: А – зовнішній вигляд особи; Б – схема розвитку гінандроморфа (1 – зигота; 2 – два перших бластомери; 3 – гінандроморф (втрата в одному з бластомерів Х-хромосоми, що несе домінантну алель червоного забарвлення очей w+) Втрата Х-хромосоми в особини, гетерозиготної за локусом «уайт», призводить до того, що на жіночій половині тіла око має червоне забарвлення, а на чоловічій, де немає другої Х-хромосоми з алеллю червонооколсті – біле. Види гінадроморфізму: Ø передньозадній; Ø латеральний; Ø мозаїчний. |
Види гінадроморфізму:
Ø передньозадній;
Ø латеральний;
Ø мозаїчний.
Поширеність мозаїцизму серед домашніх тварин:
Утворення мозаїків типу ХХ/ХУ описано у коней, овець і свиней, типу ХХУ/ХХХУ − у свиней, ХХ/ХХХХ і ХХУ/ХХ/ХУ – у великої рогатої худоби, ХХ/ХУ/ХО – у кіз.
Фримартинізм (виявлений у телиць великої рогатої худоби) − мозаїцизм (суміш клітин з набором XX- і ХУ-хромосом) лейкоцитів, клітин кісткового мозку і фібробластів у телиць і бичків, які розвивалися у парі.
Причина фримартинізму: обмін стовбурними клітинами крізь анастомози кровоносних судин плаценти при багатоплідній вагітності.
Симптоми фримартинізму: у телиць (яких називають фримартинками), що народились у парі з бичком, недорозвинені статеві органи (недорозвинені яєчники, їх переродження у сім'яники та опускання у рудиментарну мошонку, яка розміщується за вим'ям, статеві губи сильно розвернуті, піхва коротка (4-5 см замість 12-15 см у 15-денної нормальної телиці) або зовсім атрофована).
Бички, як правило, народжуються у таких випадках без порушень розвитку статевої системи. Хоча зафіксовані випадки народження бичків у парі з теличками, у яких при 40 %-й мозаїчності клітин відмічались менша густина сперми, високий відсоток мертвих сперматозоїдів, понижений рівень тестостерону і, як результат, зниження запліднюючої здатності сперми. При більш високому рівні химеризму у бичків спостерігались різко виражені аномалії – крипторхізм та вкорочення пеніса.
10. Аномальний гермафродитизм тварин і людини
Гермафродитизм – наявність в одного організмі чоловічих і жіночих статевих органів (один сім'яник і один яєчник, наявність чоловічих і жіночих недорозвинених зовнішніх статевих органів, присутність у паренхімі сім'яника паренхіми яєчника і, навпаки).
Види гермафродитизму:
Ø природний (у безхребетних);
Ø аномальний − у людей і вищих тварин (частота виникнення гермафродитів у домашніх тварин, найбільша у свиней і кіз – до 1,5 %).
Причина виникнення гермафродитизму: зміна активності гормональної секреції.
Гени чоловічої статі знаходяться в У-хромосомі, а гени жіночої статі – в Х-хромосомі. Однак, в невеликій кількості гени чоловічої статі є в Х-хромосомі і навіть в аутосомах, водночас гени жіночої статі є в чоловіків. У нормі диференціація статі у людини зумовлюється статевими гормонами ендокринних залоз і зародкової гонади. Рівень гормональної секреції контролюється балансом генів. Переважання генів чоловічої статі призводить до підвищення секреції чоловічих статевих гормонів – андрогенів і формування чоловічої статі, а переважання генів жіночої статі – до підвищення секреції жіночих статевих гормонів – естрогенів і формування жіночої статі. Однак трапляються випадки, коли під час ембріонального розвитку у зародковій гонаді з генотипом XX або XУ починає посилено діяти відповідна меншість генів чоловічої або жіночої статі, тобто відбувається зміна активності гормональної секреції. Це і призводить до розвитку гермафродитних форм.
11. Поширення генетичних аномалій у популяціях свійських тварин та їх профілактика
Поширення генетичних аномалій у популяціях
Генетичні аномалії – результат мутацій, частота яких у сільськогосподарських тварин мало вивчена, але, очевидно, її можна співставити з такою у людини.
Частота мутацій для більшості генів людини у середньому становить 1х10-5–1х10-6 за покоління.
Частота появи особин зі спадковими хворобами на 1000 новонароджених становить:
Ø аутосомно-домінантних − 7;
Ø аутосомно-рецесивних – 2;
Ø зчеплених з Х-хромосомою рецесивних хвороб – 0,4.
Генетичний вантаж – це наявність у популяції рецесивних мутацій, які при переході у гомозиготний стан зумовлюють загибель особин чи зниження їх життєздатності.
Розрізняють такі типи генетичного вантажу:
Ø мутаційний − виникає у результаті появи повторних шкідливих мутацій;
Ø перехідний (субституційний) − виникає у тих випадках, коли алель, яка забезпечувала адаптивну норму, у змінених умовах середовища стає негативною (забарвлення хутра у зайця-біляка);
Ø збалансований (сегрегаційний) − виникає у результаті того, що пристосованість гетерозигот вища, ніж гомозигот (серпоподібноклітинна анемія).
Генетичний вантаж можна виявити на всіх етапах онтогенезу шляхом обліку:
Ø загибелі ембріонів;
Ø аномалій у новонароджених;
Ø співвідношення статей;
Ø прояву аномалій у постембріональний період розвитку.
Генетичний моніторинг (запропонував Н.П. Дубінін) − спостереження за динамікою генетичної структури популяції.
Об’єм генетичного вантажу в європеоїдних популяціях людини, %
| Мутації | Частота новонароджених зі спадковими дефектами | |||
| 1962-1966 | 1977-1980 | |||
| Аутосомно-домінантні | – | 0,95 | 0,08 | 0,96 |
| Аутосомно-рецесивні | – | 0,21 | 0,11 | 0,10 |
| Зчеплені зі статтю | – | 0,04 | 0,04 | 0,04 |
| Хромосомні | – | 0,42 | 0,20 | 0,40 |
| Полігенні порушення | – | 4,00 | 9,01 | 9,01 |
| Всього | 4,0 | 5,62 | 9,44 | 10,51 |
За 24 роки серед європейського населення частота новонароджених із спадковими аномаліями збільшилась з 4 до 10,5%.
Причина зростання частоти вроджених аномалій у людини: збільшення тиску мутагенів середовища.
Причина зростання частоти вроджених аномалій у популяціях свійських тварин:
Ø збільшення тиску мутагенів середовища;
Ø міграції, або імпорт плідників (бичок Галлюс М77, який імпортований у 1890 році із Східної Фрисландії у Швецію, через своїх синів призвів до поширення рецесивної аномалії вродженої відсутності кінцівок; бичок Принц Адольф, який імпортований в 1902 році із Фрисландії, став джерелом поширення вродженого гіпотрихозу (безшерстості); імпорт голландських кнурів сприяв збільшенню частоти інтерсексуальності у німецьких ландрасів).
Значення генетичного моніторингу: немає популяцій і особин повністю вільних від генетичного вантажу, тому необхідно знати його величину і динаміку, щоб звести його до мінімуму.
Значення генетичної профілактики: дозволяє значно знизити частоту небажаний алелей у популяціях тварин і контролювати їх на низькому рівні.
Будь-яка популяція тварин насичена шкідливими генами, які виникають у результаті мутацій. У природних популяціях природний добір елімінує небажані алелі. У штучних популяціях (стадах) дія природного добору дуже слабка, і їх генетична структура підтримується штучним добором, який проводить людина. Наслідком такого добору може бути поширення спадкових аномалій у стадах тварин. Людина майже не в змозі зупинити масштаби мутагенезу, а також лікувати спадкові хвороби. Тому єдиним способом боротьби з такими хворобами є профілактика їх поширення. Однак повністю їх елімінувати у популяціях тварин неможливо. Це пов’язано з постійним виникненням мутацій, ускладненим виявленням гетерозиготних носіїв, особливо коли частота алелей у популяції дуже низька, а також у деяких випадках селективної переваги гетерозигот.
Генетична профілактика включає такі етапи:
I) діагностика спадкових аномалій;
II) виявлення та вибракування гетерозиготних носіїв аномалій;
III) здійснення селекційних заходів.
І) Діагностика спадкових аномалій включає:
Ø виявлення і опис аномалії: лікарі ветеринарної медицини клінічно дослідують всіх новонароджених, мертвонароджених і абортованих плодів та роблять опис всіх дефектів.
Ø доказ генетичної обумовленості аномалії, для чого:
· з’ясовують, чи хворіла мати у період вагітності і чим;
· з’ясовують склад кормових раціонів і наявність кормових отруєнь вагітних матерів;
· врахують всі фізичні фактори, які могли спричинити появу фенокопії;
· порівнюють опис даних аномалії з описаними у літературі;
· з’ясовують характер схрещування (інбридинг, аутбридинг тощо);
· з’ясовують, чи були серед потомків батьків нащадка такі аномалії раніше;
· з’ясовують за родоводом, чи були випадки народження виродків у предків батька і матері нащадка;
· з’ясовують генотипи батьків, проводячи аналізуюче схрещування;
У ході діагностики використовують генетичні методи, які дозволять довести генетичну обумовленість аномалій:
· генеалогічний − не завжди доводить характер успадкування ознаки, але є індикатором її спадкової обумовленості.
· цитогенетичний (зокрема каріологічий аналіз) − дозволяє виявити численні порушення каріотипу у аномальних особин та їх батьків;
· біохімічний − дозволяє виявити спадкові хвороби обміну речовин;
· імуногенетичний − дозволяє виявити імунодефіцити та антигенну несумісність матері та плоду;
· метод зчеплених генів − застосовують для виявлення хвороб, гени яких зчеплені з генетичними маркерами, такими, як групи крові і типи білків (у людини, наприклад, за допомогою цього методу можна діагностувати носіїв гемофілії).
ІІ) Виявлення та вибракування носіїв аномалій.
Гомозиготних домінантних та рецесивних носіїв легко виявити, бо вони маючи морфологічні, фізіологічні та біохімічні вади і, як правило, гинуть, не даючи нащадків. Тому людина спеціально вибраковує таких носіїв лише тоді, коли вони відносно життєздатні і можуть дати нащадків.
Для виявлення гетерозиготних носіїв використовують різні варіанти схрещування плідників:
· з аномальними самками (якщо аномалія дозволяє дожити до репродуктивного віку);
· з гетерозиготними самками;
· з дочками плідників, які були гетерозиготні;
· із самками з цієї ж популяції.
ІІІ) Здійснення селекційних заходів.
1. Лікар ветеринарної медицини зроблений опис аномалії реєструє у журналі та передає селекціонеру.
2. Селекціонер відмічає дефект у закодованому вигляді у племінних картках і генеалогічних схемах родин та надсилає відомості на племпідприємство, у якого придбана тварина, від якої отримали аномального нащадка.
3. На племпідприємстві вводять дані про аномалію в каталоги плідників і державні племінні книги та роблять висновок про можливість їх використання для розведення.
Лекція 11. СПАДКОВО-СЕРЕДОВИЩНІ ХВОРОБИ ТА ГЕНЕТИЧНА СТІЙКІСТЬ ДО НИХ ТВАРИН
План:
1. Генетична резистентність у чутливість тварин до спадково-середовищних хвороб.
2. Методи вивчення генетичної стійкості тварин до хвороб.
3. Методи та проблеми селекції на резистентність тварин до хвороб.
1. Генетична резистентність у чутливість тварин до спадково-середовищних хвороб
Спадково-середовищні хвороби − це хвороби зумовлені умовами середовища, однак їх прояв залежить і від генотипу особини. Це всі хвороби тварин (інфекційні, інвазійні і незаразні хвороби), за винятком тих, які повністю або значною мірою залежать від навколишнього середовища (наприклад, опіки). Для хвороб цієї групи характерний слабкий, середній і високий ступінь спадкової обумовленості.
Чутливість – це сприйнятливість організму до дії фізичних, хімічних і біологічних агентів, які призводять до патологічного стану, резистентність − стійкість до них.
Опосередковані докази генетичної зумовленості стійкості чи чутливості ВРХ до хвороб:
Ø тварини бестужівської породи рідко хворіють на туберкульоз, чорно-рябої − часто;
Ø худоба зебу відносно стійка проти піроплазмозу, червона степова – чутлива;
Ø гібриди від схрещування браманської і герефордської порід у два рази менше вражаються кліщами, ніж їх батьки;
Ø безпліддя і яловість можуть мати генетичну обумовленість; в організмі деяких корів утворюються високоактивні антитіла проти білків сперматозоїдів, що призводить до аглютинації (склеювання) їх під час осіменіння, обумовлюючи антигенну несумісність корови і бугая.
У тварин відмічена залежність резистентності чи чутливості від:
Ø виду − коні не хворіють чумою ВРХ; ВРХ не хворіє сапом; щурі стійкі до дифтерії; морські свинки чутливі, але стійкі до грипу;
Ø породи та лінії − різні породи овець неоднаково чутливі до сибірської виразки, алжирські вівці стійкі до цього захворювання;
Ø паратипічних факторів − генетично зумовлена резистентність до того чи іншого захворювання, як і будь-яка інша ознака організму, мінлива, на яку впливають годівля, утримання, пора року тощо.
Типи успадкування резистентності тварин до хвороб:
Ø монофакторіальний (зустрічається рідко) − зумовлена одним геном (домінантним чи рецесивним);
Ø поліфакторіальний (зустрічається найчастіше) − резистентність визначається декількома генами.
2. Методи вивчення генетичної стійкості тварин до хвороб
Для вивчення генетичної стійкості тварин до хвороб використовують такі методи:
Ø клініко-генеалогічний;
Ø аналіз міжпородної і міжлінійної різниці;
Ø селекційний експеримент;
Ø популяційно-статистичний;
Ø близнюковий.
Клініко-генеалогічний метод дозволяє виявити резистентних і схильних до хвороби тварин і використовувати дані при розробці селекційних програм.
Аналіз міжпородної і міжлінійної різниці дозволяє виявити відмінності між резистентністю тварин різних порід і ліній, і якщо вона є, підтвердити доцільність подальшої селекції.
Селекційний експеримент дозволяє виявити резистентність тварин до хвороби і підтвердити доцільність подальшої селекції. Чим успішніша селекція, тим більша імовірність того, що стійкість контролюється невеликою кількістю генів.
Популяційно-статистичний метод застосовується для вивчення стійкості до мультифакторіальних хвороб. Для цього використовують не лише частоти генів та генотипів, а також середні арифметичні, середні квадратичні відхилення, варіанси, коефіцієнти кореляції та регресії між родичами.
У всіх цих методах визначають частоту захворювання – це відношення кількості хворих тварин до їх загальної кількості у стаді помножене на 100:
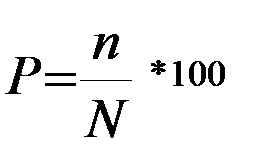 ,
,
де P – частота захворювання, %; N – загальна кількість тварин у стаді, голів; n – кількість хворих тварин, голів.
Близнюковий метод дозволяє визначити співвідносну роль генетичних і паратипічних факторів у прояві хвороб. Для цього експериментально визначають конкордатність і дискордантність однояйцевих та двояйцевих близнюків та розраховують коефіцієнт успадкування і ступінь впливу паратипічних факторів на прояв хвороби.
Конкордантність однояйцевих (КОБ) та двояйцевих (КДБ) – це присутність або відсутність хвороби у обох близнюків, дискордантність – наявність хвороб у одного близнюка і відсутність у іншого.
Ступінь впливу генетичних факторів на прояв хвороби визначають формулою:
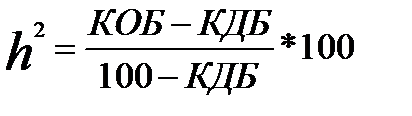 ,
де h2 – коефіцієнт успадкування, %; КОБ – конкордантність однояйцевих близнюків, %; КДБ – конкордантність двояйцевих близнюків, %. ,
де h2 – коефіцієнт успадкування, %; КОБ – конкордантність однояйцевих близнюків, %; КДБ – конкордантність двояйцевих близнюків, %.
| Якщо: Ø h2=1 (100%) – хвороба зумовлена генотипом; Ø h2=0 (0%) – хвороба зумовлена паратипічними факторами; Ø h2≤0,5 (50%) – хвороба обумовлена переважно паратипічними факторами. |
| Ступінь впливу паратипічних факторів на прояв хвороби можна за визначають формулою: С = 100 – h2, де С – ступінь впливу паратипічних факторів на прояв хвороби, %; h2 – коефіцієнт успадкування, %. | Якщо: Ø С=1 (100%) – хвороба зумовлена паратипічними факторами; Ø С=0 (0%) – хвороба зумовлена генетичними факторами; Ø С≤0,5 (50%) – хвороба обумовлена переважно паратипічними факторами. |
3. Методи та проблеми селекції на резистентність тварин до хвороб
Хвороби викликають загибель значної кількості тварин і зниження продуктивності, тому наносить великі економічні збитки у тваринництві. Тому боротьба (профілактика і лікування) з ними має важливе значення.
У селекції генетично стійких тварин використовують два методи:
1. Штучне зараження тварин, при якому частина їх хворіє та гине, а частина залишається здоровою, що обумовлено їх індивідуальною спадковою резистентністю. Цих тварин використовують для подальшого розмноження і селекції на резистентність нащадків наступних генерацій. Цей метод не може широко застосовуватись у промислових умовах, а вимагає експериментальних умов.
2. Проведення генетичного аналізу родин за зоотехнічною та ветеринарною документацією, що дозволяє виявити резистентних тварин і спрямовувати селекцію у потрібному напрямку. Цей метод може бути широко впроваджений у виробництво.
Проблеми селекції тварин на резистентність:
Ø здатність мікроорганізмів до високої мінливості − за короткий проміжок часу один і той же вид мікроорганізмів мутуе, змінюючи свою спадковість, у результаті цього раніше резистентні тварини стають чутливими;
Ø інбридинг − призводить до підвищення гомозиготності стад і порід, що викликає інбредну депресію, знижує резистентність інбредних нащадків, збільшує поширення у популяції небажаних рецесивних генів і гомозиготних генотипів.
Лекція 12. ОСНОВИ ІМУНОГЕНЕТИКИ ТА БІОХІМІЧНИЙ ПОЛІМОРФІЗМ БІЛКІВ
План:
1. Імуногенетика як наука.
2. Генетичні системи груп крові тварин і людини.
3. Імуногенетична несумісність матері і плода.
4. Біохімічний поліморфізм білків.
5. Практичне використання досягнень імуногенетики у тваринництві.
Date: 2015-09-02; view: 3331; Нарушение авторских прав