
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Люминесцентные методы анализа. Классификация, причины возникновения, основные характеристики и закономерности люминесценции. Тушение люминесценции
|
|
Люминесцентной спектроскопией называют группу эмиссионных спектроскопических методов анализа, основанных на явлении люминесценции. Люминесценцией называется свечение атомов, молекул и других более сложных частиц, возникающее в результате электронного перехода при их возвращении из возбуждённого состояния в основное.
Классификация по способу (источнику) возбуждения: Фотолюминесценция – свечение вещества, возникающее под воздействием излучения в видимой и УФ области спектра. Хемилюминесценция – свечение вещества за счет энергии химических реакций. Рентгенолюминесценция – свечение вещества под воздействием рентгеновских лучей. Катодолюминесценция – свечение вещества в газовой фазе при бомбардировке его потоком электронов (катодными лучами). Термолюминесценция – свечение вещества вследствие его возбуждения при нагревании.
Классификация по длительности послесвечения: Флуоресценция (спонтанная люминесценция) – свечение, прекращающееся сразу после прекращения действия источника возбуждения. Флуоресцирующие вещества называются флуорохромами. Фосфоресценция – свечение, продолжающееся некоторое время после прекращения действия источника возбуждения.
При поглощении кванта света молекула вещества переходит из основного электронного состояния в возбуждённое. Одной из характеристик электронного состояния является мультиплетность. Основное состояние молекулы обычно является синглетным. Возбуждённые состояния могут быть как синглетными, так и триплетными. Когда молекула поглощает свет, она за очень короткое время переходит на какой-то колебательный и вращательный уровень одного из возбуждённых синглетных состояний. Да-
лее с возбуждённой молекулой могут происходить 2 типа процессов: безызлучательные и излучательные.
Основными характеристиками люминесценции являются: спектр возбуждения, спектр испускания (спектр люминесценции), квантовый и энергетический выходы, поляризация, время жизни и т.д.
Спектр возбуждения люминесценции (флуоресценции, фосфоресценции) - зависимость интенсивности испускаемого света с фиксированной длиной волны от длины волны или другой волновой характеристики возбуждающего света. Спектр люминесценции - зависимость интенсивности испускаемого света от его длины волны при фиксированной длине волны возбуждающего света. Квантовый выход - отношение числа испускаемых фотонов к числу поглощаемых. Энергетический выход - отношение энергии излучаемого
света к энергии поглощаемого.
Интенсивность флуоресценции вещества и её квантовый выход могут снижаться в присутствии в растворе других веществ, называемых тушителями. Существуют, так называемые, универсальные тушители (например, O2), которые уменьшают флуоресценцию большинства веществ. Однако, чаще тушитель влияет на флуоресценцию одного вещества и не влияет на флуоресценцию другого (например, хлориды уменьшают интенсивность флуоресценции хинина), поскольку эффект тушения в разных случаях имеет различный механизм. Влияние концентрации тушителя на интенсивность флуоресценции вещества описывается уравнением Штерна-Фольмера: I/Iq = 1+kCq, где Iq - интенсивность флуоресценции в присутствии тушителя, Сq – концентрация тушителя, k - константа тушения.
Влияние различных факторов на интенсивность люминесценции растворов. Устройство и принцип работы приборов, применяемых для измерения флуоресценции. Основные приемы, используемые в люминесцентных методах анализа.
Интенсивность флуоресценции зависит от:
· природы вещества (неорганические вещества обычно не способны флуоресцировать в растворе, органические наоборот); Наиболее часто флуоресцирующие вещества встречаются среди ароматических соединений. Введение в бензольное кольцо электронодонорных заместителей увеличивает способность вещества флуоресцировать. Например, многие фенолы и ароматические амины обладают интенсивной флуоресценцией. Введение электроноакцепторных заместителей, за некоторым исключением, уменьшает флуоресценцию. Атомы тяжёлых галогенов (Br, I) уменьшают квантовый выход флуоресценции. Однако введение тяжёлых галогенов увеличивает квантовый выход флуоресценции. Способность вещества к флуоресценции в растворе увеличивается при конденсации ароматических колец и увеличении «жёсткости» молекулы.
· концентрации вещества в растворе (при малых значения оптической плотности зависимость интенсивности флуоресценции от концентрации можно считать линейной. При более высоких значениях оптической плотности, зависимость интенсивности флуоресценции от концентрации становится более сложной и отклоняется от линейной);
Влияние оптической плотности раствора на интенсивность флуоресценции называется «эффектом внутреннего фильтра». Этот эффект обусловлен двумя причинами:
поглощением возбуждающего света, вследствие чего частицы, находящиеся дальше от источника излучения, будут получать меньше возбуждающего излучения;
поглощением одними частицами вещества излучения, испускаемого другими частицами этого же вещества.
· условий, в которых находится флуоресцирующее вещество (температура, растворитель, рН, наличие в растворе других веществ, способных влиять на флуоресценцию).
Для измерения интенсивности флуоресценции используют спектрофлуориметры и флуориметры. В качестве источника излучения используют ртутную, ксеноновую и другие лампы, лазеры. Для выделения нужного спектрального интервала в флуориметрах, как и в фотоэлектроколориметрах, используют светофильтры и монохроматоры. Наиболее широкое применение среди перечисленных люминесцентных методов анализа имеет флуориметрия. По сравнению со спектрофотометрией флуориметрия обладает: большей избирательностью (не все вещества, поглощающие УФ- и видимое излучение, способны флуоресцировать); более низким пределом обнаружения (измерить абсолютную величину малого сигнала всегда легче, чем разность между двумя большими сигналами); удобным временным диапазоном.
Флуоресцентный анализ используют для обнаружения и для количественного определения веществ. В качественном анализе чаще всего используется способность вещества флуоресцировать тем или иным цветом. В количественном анализе используют зависимость интенсивности флуоресценции от концентрации флуоресцирующего вещества.
В флуоресцентном анализе используется: измерение собственной флуоресценции вещества; получение флуоресцирующих продуктов, в том числе и экстракционная флуориметрия; определения, основанные на тушении флуоресценции; титрование с флуоресцентными индикаторами.
Общая характеристика и теоретические основы хроматографических методов анализа. Принцип метода. Классификация хроматографических методов по типам подвижных фаз и по механизму взаимодействия сорбат-сорбент.
Хроматография - метод разделения смесей веществ или частиц, основанный на различии в скоростях их перемещения в системе, состоящей из несмешивающихся и движущихся друг относительно друга фаз.
В качестве неподвижной фазы в хроматографическом процессе выступает твёрдое вещество (сорбент) или плёнка жидкости, нанесённая на твёрдый носитель, а в качестве подвижной фазы – жидкость или газ, протекающий через неподвижную фазу.
Эффект разделения основывается на том, что соединения проходят расстояние, на котором происходит разделение, с некоторой, присущей этому соединению задержкой. Хроматографический процесс состоит из целого ряда актов сорбции и десорбции, а также растворения и элюирования, которые каждый раз приводят к новому равновесному состоянию.
Существует более 50 различных хроматографических методов и
вариантов.
Классификация хроматографических методов по типам подвижных фаз:
• газовая
• газоадсорбционная (газотвердофазная)
• газо-жидкостная
• жидкостная
• жидкотвердофазная
• жидко-жидкофазная
• жидко-гелевая
Классификация хроматографических методов по механизму взаимодействия сорбат-сорбент:
· адсорбционная хроматография (Различная адсорбируемость разделяемых веществ неподвижной фазой)
· Абсорбционно-комплексообразовательная хроматография (Образование (в подвижной фазе или на поверхности неподвижной фазы) различных по устойчивости комплексных соединений)
· Ионообменная хроматография (Различная способность разделяемых веществ к ионному обмену)
· Эксклюзионная хроматография (Различия в размерах и форме молекул разделяемых веществ)
· Гель-хроматография, ситовая хроматография (Неподвижная фаза – растворитель, находящийся в порах геля, а подвижная – сам растворитель, т.е. подвижная и неподвижная фаза – одно и то же вещество, или одна и та же смесь растворителей)
· Распределительная хроматография (Различная растворимость разделяемых веществ в неподвижной фазе или в подвижной и неподвижной фазах)
· Осадочная хроматография (Образование осадков, различающихся по растворимости)
· Афинная хроматография (Различная способность разделяемых веществ к биоспецифическим взаимодействиям)
61.Хроматографические параметры удерживания и разделения. Приемы количественного определения в хроматографии (методы внутреннего стандарта, внешнего стандарта, внутренней нормализации).
1)параметры удерживания и разделения:
· Время удерживания
Время удерживания tR состоит из времени пребывания вещества в подвижной фазе (tm) и времени пребывания вещества в неподвижной фазе (ts).tR = tm + ts
Приведенное время удерживания- tR`, где - toвремя прохода газа (жидкости) через саму хроматографическую колонкуtR` = tR-to
· Удерживаемый объем
VR = tRv, где V- скорость подвижной фазы
Абсолютный удельный удерживаемый объем, (отнесенный к массе сорбента, с учетом температуры) V g =273,16 × V/mT

· Селективность разделения (α) – способность хроматографической системы (сорбента и подвижной фазы) разделять определяемые компоненты. Разделение возможно при α ˃1. (α) = VR2 / VR1
62.Общая характеристика газовой хроматографии. Теории хроматографического разделения – теоретических тарелок и кинетическая теория (Ван-Деемтера).
Газовая хроматография – хроматографический метод анализа, в котором подвижной фазой является газ.
1)Теория теоретических тарелок
Число N теоретических тарелок, при длине слоя сорбента L и высоте -H, эквивалентной теоретической тарелке (ВЭТТ): N= L/H
H=w2L/16t2R – w – ширина пика у основания
2)Кинетическая теория
Учитывает реальные особенности протекания хроматографического процесса.
Размывание хроматографической зоны обусловлено тремя основными причинами:
1) вихревая диффузия (скорость потока у стенок и в средине колонки различна) и зависит от качества заполнения колонки; 2) продольная диффузия; 3) сопротивление массопереносу
Уравнение Ван-Деемтера, Н=ВЭТТ, U – скорость потока подвижной фазы: H= A + B/U + CU
Общая характеристика газовой хроматографии. Устройство и принцип работы газового хроматографа. Особенности газотвердофазной и газожидкостной хроматографии. Характеристика подвижных, неподвижных фаз и носителей. Аналитическое применение метода.
Схема газового хроматографа:1-газовый баллон 2- редуктор 3- дозатор 4-испаритель 5-хроматографическая колонка 6-детектор 7регистрирующее устройство 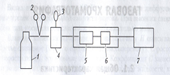
1) Газо-твердофазная хр.(Неподвижной фазой является твердый адсорбент, на котором происходит разделение компонентов)
2) Газо-жидкостная хр. (Неподвижной фазой является пленка жидкости, нанесенная на частицы твердого адсорбента. Адсорбент – инертный, во избежание модификации жидкости)
Date: 2015-08-15; view: 3403; Нарушение авторских прав