
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Краткая теория. Как известно, вещества в твердом состоянии испускают излучение со сплошным спектром, одинаковым для всех тел
|
|
Как известно, вещества в твердом состоянии испускают излучение со сплошным спектром, одинаковым для всех тел. В разреженных газах или в парах металлов взаимодействие между отдельными атомами незначительно. Поэтому спектры таких газов состоят из отдельных спектральных линий различных частот, строго определенных для каждого химического элемента. Такой спектр называется линейчатым. Таким образом, по линейчатому спектру можно определить, какой элемент присутствует в газе.
Изучение атомных спектров послужило ключом к познанию строения атомов. Было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы, которые получили название серий. Некоторые линии (или полностью серии линий) лежат в видимой области спектра, но большая часть находится в инфракрасной или ультрафиолетовой областях спектра. Проще всего пронаблюдать эти закономерности на примере простейшего атома – атома водорода.
В 1885 г. швейцарский физик Бальмер пронумеровал спектральные линии видимого излучения атома водорода и установил связь между длиной волны линии и её номером:
 , ,
| (6.1) |
где λ – длина волны; R – опытная постоянная (постоянная Ридберга); m – номер линии. Однако, нумерация начиналась не с единицы, а с трёх: m 1 = 3, m 2 = 4, m 3 = 5 и т. д.
Формула (6.1) называется формулой Бальмера, а соответствующая серия линий – серией Бальмера. Всего в серии Бальмера насчитывают около 30 линий, часть из которых уходит в ультрафиолетовую область спектра. Позднее были обнаружены и другие серии. В ультрафиолетовой области спектра находится серия Лаймана, остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены аналогичными формулами:
серия Лаймана (в ультрафиолетовой области)
 ; ;
| (6.2) |
серия Пашена (в близкой инфракрасной области)
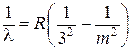 . .
| (6.3) |
Таким образом, длину волны любой линии можно представить одной формулой, которая называется сериальной:
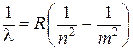 , ,
| (6.4) |
где n = 1, 2, 3, 4, 5; m и n – целые числа. При заданном n число m принимает значения, начиная с n + 1.
Объяснение закономерностей расположения линий в спектре можно получить, основываясь на теории атома водорода, предложенной Н. Бором. Опытами Э. Резерфорда было установлено, что атом любого элемента состоит из положительно заряженного ядра, вокруг которого расположены отрицательно заряженные электроны. Электроны вращаются вокруг ядра подобно тому, как планеты вращаются вокруг Солнца. На электроны со стороны ядра действует сила Кулона, которая сообщает им центростремительное ускорение. По II закону Ньютона
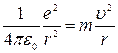 . .
| (6.5) |
Согласно электромагнитной теории вращающийся по орбите электрон возбуждает вокруг себя переменное электромагнитное поле. Это означает, что вращение электрона должно сопровождаться излучением, на которое электрон тратит часть своей энергии. В результате электрон должен упасть на ядро. В действительности этого не происходит, и атом является устойчивой системой. Кроме того, из формулы (6.5) следует, что с уменьшением радиуса орбиты скорость электрона возрастает, т. е. период обращения уменьшается. Это должно привести к непрерывному увеличению частоты излучаемых электромагнитных волн, и спектр излучения атома должен быть сплошным. Но опыты показывают, что атом излучает линейчатый спектр. Выход из создавшегося положения предложил Бор в 1913 г.
Бор сформулировал законы движения электрона в атоме и характер излучения атома в виде постулатов, которые дали объяснение экспериментальным фактам.
Первый постулат. Электрон в атоме может двигаться только по строго определенным – стационарным орбитам, находясь на которых, он не излучает энергию. Радиус стационарных орбит определяется из условия: момент импульса электрона кратен постоянной Планка:
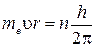 (n = 1, 2, 3, …). (n = 1, 2, 3, …).
| (6.6) |
Второй постулат. Излучение испускается или поглощается в виде светового кванта, энергия которого пропорциональна частоте излучения
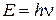 , ,
| (6.7) |
и равна разности энергий тех стационарных состояний, между которыми совершается переход электрона:
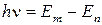 . .
| (6.8) |
На рис. 6.1 схематически показаны переходы электрона, которые связаны с появлением видимых линий в спектре атома водорода. Физический смысл чисел n и m легко понять с помощью формулы (6.8): это номера орбит, между которыми происходит переход электрона. При переходе с ближней орбиты на более удалённую от ядра (на рисунке это переход 2®3) происходит поглощение энергии hn 1. И наоборот, излучение энергии происходит при переходе электрона с дальних орбит на более близкие к ядру (4®2, 5®2).
 Используя формулы (6.4)–(6.6), можно получить выражение для постоянной Ридберга через фундаментальные постоянные (h, e, m, c). Вычисленное по этой формуле значение постоянной Ридберга с большой точностью совпадает с экспериментальным. Опытным путем это значение можно получить с помощью формулы (6.1) по нескольким известным длинам волн.
Используя формулы (6.4)–(6.6), можно получить выражение для постоянной Ридберга через фундаментальные постоянные (h, e, m, c). Вычисленное по этой формуле значение постоянной Ридберга с большой точностью совпадает с экспериментальным. Опытным путем это значение можно получить с помощью формулы (6.1) по нескольким известным длинам волн.
Несмотря на удачное объяснение спектральных закономерностей водородоподобных атомов, теория Бора обладает рядом недостатков. В частности, она не может объяснить спектры излучения более сложных атомов и различную интенсивность спектральных линий. Эти трудности были преодолены квантовой теорией, показавшей неприменимость классических представлений к микрообъектам.
Date: 2015-08-06; view: 406; Нарушение авторских прав