
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулярна фізика і термодинаміка
|
|
| Назва | Величина, її визначення | Одиниця вимірювання |
| Основи молекулярно-кінетичної теорії | ||
| Кількість речовини | ||
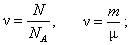 m = m 0 N, m = nm; m = m 0 N, m = nm; 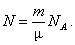
| n - кількість молів молекул (або інших структурних одиниць) | моль |
| N - кількість частинок | ||
| N A = 6,02·1023 моль-1 - число Авогадро | ||
| m - маса речовини | кг | |
| m - молярна маса | кг/моль | |
| m 0 - маса молекули (атома) | кг | |
| Основне рівняння молекулярно-кінетичної теорії | ||
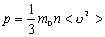 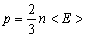 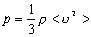 p = nkT p = nkT
| p - тиск газу | Па |
| m - маса молекули (атома) | кг | |
| n - концентрація молекул | м-3 | |
< 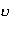 2> - середній квадрат швидкості молекул 2> - середній квадрат швидкості молекул
| м2/с2 | |
| r - густина газу | кг/м3 | |
| < E > - середня кінетична енергія молекул | Дж | |
| Т - абсолютна температура | К | |
| k = 1,38·10-23 Дж/К - стала Больцмана | ||
| Середня кінетична енергія руху молекул. Температура | ||
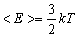
| < E > - середня кінетична енергія молекул | Дж |
| k - стала Больцмана | Дж/К | |
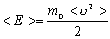
| m - маса молекули | кг |
< 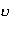 2> - середній квадрат швидкості молекул 2> - середній квадрат швидкості молекул
| м2/с2 | |
| T = (t °C + 273,15) K t = (T - 273,15) °C | T - абсолютна температура або температура в кельвінах | К |
| t - температура в градусах Цельсія | °С | |
| Середня квадратична швидкість молекул | ||
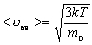 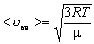
| < 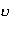 кв> - середня квадратична швидкість молекул кв> - середня квадратична швидкість молекул
| м/с |
| R - універсальна газова стала | 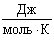
| |
| k - стала Больцмана | Дж/К | |
| T - абсолютна температура | К | |
| m - маса молекул | кг | |
| m - молярна маса | кг/моль | |
| Рівняння стану ідеального газу | ||
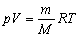 pV = n RT pV = n RT 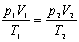
| p - тиск газу | Па |
| V - об'єм газу | м3 | |
| m - маса речовини | кг | |
| n- кількість молів молекул газу | моль | |
| R - універсальна газова стала | 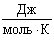
| |
| m - молярна маса | кг/моль | |
| Основи термодинаміки | ||
| Внутрішня енергія ідеального одноатомного газу | ||
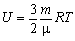 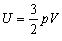
| U - внутрішня енергія газу | Дж |
| m - маса газу | кг | |
| m - молярна маса | кг/моль | |
| R - універсальна газова стала | 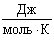
| |
| T - абсолютна температура | К | |
| p - тиск газу | Па | |
| V - об'єм газу | м3 | |
| Робота в термодинаміці | ||
A = p D V 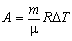
| A - робота, що виконана над системою | Дж |
| p - тиск газу | Па | |
| D V - зміна об'єму газу | м3 | |
| m - молярна маса | кг/моль | |
| Кількість теплоти. Теплообмін | ||
| Q = cm (T 2 - T 1) Q = rmQ = l mQ = qm | T 1 і T 2 - початкова і кінцева температури тіла | К |
| Q - кількість теплоти | Дж | |
| c - питома теплоємність | 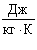
| |
| m - маса речовини | кг | |
| r - питома теплота пароутворення | Дж/кг | |
| l - питома теплота плавлення | Дж/кг | |
| q - питома теплота згоряння палива | Дж/кг | |
| Перший закон термодинаміки | ||
| D U = A' + QQ = D U + A | D U - зміна внутрішньої енергії | Дж |
| Q - кількість теплоти | Дж | |
| A' - робота зовнішніх сил над газом | Дж | |
| A - робота газу над зовнішніми тілами | Дж | |
| ККД теплового двигуна | ||
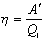 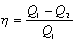
| A' - корисна робота | Дж |
| h - ККД | ||
| Q 1 - кількість теплоти, яку одержало робоче тіло від нагрівника | Дж | |
| Q 2 - кількість теплоти, яку віддало робоче тіло холодильнику | Дж | |
| Молекулярні явища в різних агрегатних станах | ||
| Відносна вологість повітря | ||
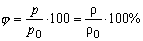
| j - відносна вологість | % |
| p - парціальний тиск водяної пари | Па | |
| p 0 - тиск насиченої водяної пари | Па | |
| r - густина ненасиченої водяної пари при даній температурі | кг/м3 | |
| r0 - густина насиченої водяної пари | кг/м3 | |
| Поверхневий натяг | ||
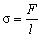 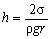
| s - коефіцієнт поверхневого натягу | Н/м |
| F - сила поверхневого натягу | Н | |
| l - довжина периметру змочування | м | |
| h - висота підняття або опускання рідини в капілярі | м | |
| r - густина рідини | кг/м3 | |
| r - радіус капіляру | м | |
| g - прискорення вільного падіння | м/с2 | |
| Закон Гука | ||
s = ES 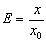 (F пр) x = – kx (F пр) x = – kx 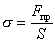
| F пр - сила пружності матеріалу | Н |
| (F пр) x - проекція сили пружності матеріалу на вісь Оx | H | |
| E - модуль Юнга | Па | |
| S - площа поперечного перерізу тіла | м2 | |
| x 0 - початкова довжина тіла | м | |
| x - абсолютна деформація | м | |
| k - коефіцієнт жорсткості | Н/м | |
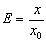 - відносне видовження - відносне видовження
| ||
| s - механічна напруга | Па |
Date: 2015-07-27; view: 545; Нарушение авторских прав