
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закінчення сухого залишку, оформлення та перевірка результатів
|
|
КОНТРОЛЬ РЕЗУЛЬТАТІВ ХІМІЧНОГО АНАЛІЗУ
Після експериментального визначення усіх основних компонентів води проводиться перевірка якості зробленого аналізу. Для цього вираховують похибку аналізу за формулою:
похибка, % = 
де А - величина сухого залишку, мг/л;
М - мінералізація (сума катіонів та аніонів), мг/л;
[HCO3 -] - вміст гідрокарбонатного іону, мг/л.
РЕЗУЛЬТАТИ ХІМІЧНОГО АНАЛІЗУ
Результати хімічного аналізу води зображаються у трьох формах:
1) вагова концентрація у літрі (мг/л);
2) еквівалентна концентрація (мг-екв/л);
3) процент-еквівалент (% мг-екв).
Для перерахунку однієї форми у іншу застосовують спеціальні таблиці та номограми. За їх відсутністю слід числове значення еквівалентної форми (мг-екв/л) помножити на еквівалентну масу іону, отримавши вагову концентрацію (мг/л). У зворотньому випадку кількість мг/л слід поділити на еквівалентну вагу іону, отримавши кількість мг-екв/л цього іону. Еквівалентна вага іону дорівнює частці при діленні молекулярної маси іону на його валентність.
Е.в. SO42- =  .
.
Для розрахунку %-мг-екв. іонів приймають суму мг-екв/л аніонів за 100% та вираховують процент кількості мг-екв/л кожного аніону по відношенню до цієї суми. Аналогічно зробити щодо катіонів.
З метою більш наочного, простого та досить точного зображення хімічного складу природної води широко застосовується формула Курлова (1928 г). Вона являє собою псевдодріб, чисельник якої складають %-мг-еквіваленти аніонів почергово від більшого до меншого, а знаменник – так само %-мг-еквіваленти катіонів.
Останній варіант формули запропонований І.Ю. Соколовим і складається з іонів, що мають %-мг-еквівалент більше одиниці. Крім того, ліворуч від формули записується вміст газів та мікрокомпонентів (у мг/л). Далі записується мінералізація води (М), яка має вид дробу: у чисельнику її вагова форма (г/л), у знаменнику – сума аніонів у мг-еквівалентах у літрі. Далі йде псевдодріб Курлова (з точністю до цілих %). Праворуч від формули записують показники, що характеризують стан води (рН, Еh, ТоС, перманганатна окислюваність у мгO2/л.
На прикладі аналізу мінеральної води "Міргородська" (Полтавська область), що поданий у таблиці хімічного складу, розраховуємо формулу Курлова для неї.
Таблиця хімічного складу мінеральної води "Миргородська".
| Аніони | мг/л | мг-екв/л | %-екв | Катіони | мг/л | мг-екв/л | %-екв |
| Сl- | 118,3 | 33,3 | 74,3 | Na | 958,6 | 41,7 | 92,9 |
| SO42- | 187,6 | 3,91 | 8,7 | Ca | 32,1 | 1,6 | 3,6 |
| HCO3- | 461,2 | 7,6 | 17,0 | Mg | 18,3 | 1,5 | 3,3 |
| I2вільн | 0,5 | Fe3+ | 1,6 | 0,09 | 0,2 | ||
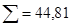
| 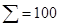
| 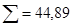
| 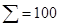
|
Мінералізація – 2,843 г/л
Формула Курлова має вигляд:
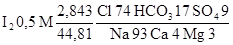 .
.
При найменуванні хімічного типу води враховують всі іони, вміст яких перевищує 20%-мг-еквівалентів, спочатку назвавши з меншим вмістом, потім – з більшим вмістом. На разі хімічна назва Миргородської води буде такою: хлоридна натрієва.
Оцінка якості води
Основним показником, який визначає придатність води для різних цілей, є хімічний склад води і концентрація її компонентів. Вода, яку використовують для пиття та господарських цілей повинна бути прозорою, безбарвною та не мати неприємних запаху та присмаку.
Таблиця оцінки якості води для господарсько-питного водопостачання.
| № п/п | Найменування показників | Одиниця виміру | Норма Державних санітарних правил "Вода питна" № 136/1940 від 15.04.97 | Результат аналізу | Висновок |
| Водневий показник рН | одиниці | 6,5-8,5 | |||
| Мінералізація загальна (сухий залишок) | мг/куб.дм | від 100 до 1000 | |||
| Твердість загальна | мг-екв/куб.дм. | від 1,5 до 7,0 | |||
| Сульфати | мг/куб.дм | не більше 250 | |||
| Хлориди | мг/куб.дм | не більше 250 | |||
| Залізо | мг/куб.дм | не більше 0,3 | |||
| Магній | мг/куб.дм | від 10 до 80 | |||
| Лужність загальна | мг-екв/куб.дм. | від 0,5 до 6,5 | |||
| Нітрати | мг/куб.дм | не більше 45,0 |
Підземні води можуть мати агресивні властивості, тобто розчинну або руйнуючу здатність по відношенню до бетону, залізобетонних споруд та до металів. Ступіь агресивного впливу визначається концентрацією агресивних агентів, температурою та напором (фільтраційними властивостями грунтів).
Для слабкопроникних порід агресивність води не нормується.
Таблиця норм агресивності води-середовища до бетону та залізобетонних споруд.
| № п/п | Ознака агресивності | Норми для безнапірних споруд | Результат аналізу | Висновок |
| Бікарбонатна лужність | < 1,4 мг-екв/л | |||
| Загальнокислотна (водневий показник рН) | < 6,5 | |||
| Агресивна вуглекислота | >15 мг/л | |||
| Магнезіальна | більше 1000 мг/л | |||
| Сульфатна | більше 500 мг/л |
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ:
1. Державні санітарні правила і норми "Вода питна. Гігієнічні вимоги до якості води централізованого господарсько-питного водопостачання". №136/1940 від 15.04.97.
2. Алєкін О.А., Семенов А.Д., Скопинцев Б.А. Руководство по химическому анализу вод суши. Л. Гидрометеоиздат, 1978.
3. Кульский Л.А., Левченко Т.М., Петрова М.В. Химия и микробиология воды: практикум. К., Вища школа, 1987.
4. Резников А.А.. Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод М."Недра", 1970
5. Посохов Е.В. Общая гидрогеохимия. Л, "Недра", 1975.
6. Солодухин М.А., Архангельский И.В. Справочник техника-геолога по инженерно-геологическим и гидрогеологическим работам. М. "Недра", 1982.
Еквіваленті маси елементів
| Na+ | 22,9898 |
| K+ | 39,1020 |
| Ca2+ | 20,0400 |
| Mg2+ | 12,1525 |
| NH4+ | 18,0386 |
| Fe2+ | 27,9235 |
| Fe3+ | 18,6157 |
| Cl- | 35,4530 |
| SO42- | 48,0308 |
| HCO32- | 61,0173 |
| CO32- | 30,0047 |
| NO3- | 62,0049 |
| NO2- | 46,0055 |
| I- | 126,9044 |
Додаток 1
ДОКУМЕНТАЛЬНЕ ОФОРМЛЕННЯ АНАЛІЗУ
БЛАНК ПОЛЬОВОГО АНАЛІЗУ ВОДИ
Експедиція__________________________________________________________
Місце відбору проби__________________________________________________
Глибина та умови відбору______________________________________________
Дата відбору_________Дата доставки__________
Пробу відібрав__(прізвище)____________________________________________
Температура води_____________________________________________________
Фізичні властивості води______________________________________________
Колір_______________________________________________________________
Прозорість__________________________________________________________
Запах_______________________________________________________________
| Компонент | мг/л | мг-екв/л | %-екв | Розрахункові дані |
| рН | ||||
| O2 | Твердість води загальна, мг-екв/л | |||
| H2S | ||||
| Fe2+ | ||||
| Fe3+ | Твердість карбонатна, мг-екв/л | |||
| NO2- | ||||
| NO3- | ||||
| NH4+ | Сума мінеральних речовин, мг/л | |||
| SO42- | ||||
| Cl- | ||||
| CO32- | Сума аніонів, мг-екв/л | |||
| HCO3- | ||||
| Ca2+ | Сума Na+ + K+ (розрахункова), мг/л | |||
| Mg2+ |
Дата виконання аналізу______________________
Аналіз виконав_______________(підпис)
Додаток 2
ПАСПОРТ СТАНДАРТНОГО АНАЛІЗУ ВОДИ
Об‘єкт__________________________________________________________________
А - величина сухого залишку,мг/л;
М - мінералізація (сума катіонів та аніонів),мг/л;
НСО3 - - вміст гідрокарбонатного іону, мг/л.
ФІЗИЧНІ ВЛАСТИВОСТІ
Температура____________Водневий показник pH______________
Прозорість____________Окислюваність__________мг/л_________
Колір_____________Твердість загальна,мг-екв/л_____________
Запах_____________Твердість карбонатна,мг-екв/л____________
| Катіони | мг/л | мг-екв/л | %-екв | Аніони | мг/л | мг-екв/л | %-екв |
| Кальцій, Са2+ | Хлориди, Сl- | ||||||
| Магній,Mg2+ | Сульфати, SO42- | ||||||
| Натрій(Na++K+) | Гідрокарбо-нати, НСО32- | ||||||
| Залізо закисне, Fe3+ | Карбонати СО32- | ||||||
| Залізо окисне, Fe2+ | Нітріти, NO2- | ||||||
| Амоній, NH4+ | Нітрати, NO3- | ||||||
| ∑ | ∑ |
Вільна вуглекислота CO2...мг/л
Агресивна вуглекислота CO2... мг/л
Розчинний кисень O2...мг/л
Мінералізація (K + A)...мг/л
Формула хімічного складу (формула Курлова)
Визначення натрію та калію.
Іони натрію (а також калію, кальцію та магнію) присутні у всіх природних водах. Кількість натрію у природних водах коливається від декількох мг/л до сотен г/л (розсоли).
Вміст калію у природних водах значно менший, бо він добре сорбується поглинаючим комплексом грунтів та витрачається на підживлення рослин. Найбільш точним методом визначення натрію та калію є метод полум‘яної фотометрії за допомогою приладу ПАЖ-1.
Він базується на здатності атомів цих елементів збуджуватись у газовому полум‘ї, а при переході у нормальний стан випромінювати енергію у вигляді спектру ліній. При цьому кожен елемент має свій, характерний тільки для нього спектр. Вилучена з спектру аналітична лінія елементу вловлюється фотоелементом приладу, посилюється електричною схемою та виводиться на рееструючий стрілочний екран. Чим більший фотострум у приладі, тим сильніше відхилення стрілки, тим більша кількість елементу міститься у розчині. Для вилучення аналітичної лінії у приладі використовують інтерференційні та абсорбційні світлофільтри, максимум пропускання яких співпадає з аналітичною лінією елементу. Розрахунок концентрації елементу у воді зводиться до отримання графіку залежності сили фотоструму від вмісту елементу у стандартних розчинах з відомою концентрацією елементу. Показання приладу при фотометрії проби залежать від тиску компресора та коливання електричного струму, тому для більш точних вимірювань вживається метод обмежуючих розчинів, коли після фотометрування розчину, що аналізується фотометрують два стандартних з більшим та меншим вмістом елементу, ніж у пробі, що аналізується. Розрахунок ведуть за формулою:
X - X1 = 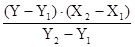 (мг/л)
(мг/л)
де Х - концентрація елементу, що визначається, мг/л;
Y - показання приладу при фотометруванні досліджуваної проби;
Х1 - концентрація елементу, що визначається у стандартному розчині
з меншим вмістом елементу;
Х2 - концентрація елементу, що визначається у стандартному розчині з
більшим вмістом елементу;
Y1 - показання приладу при фотометруванні меншого стандарту;
Y2 - показання приладу при фотометруванні більшого стандарту;
Визначення натрію іонометричним способом
Метод заснован на вимірюванні різниці потенціалів, що виникають на межі розподілу скляної мембрани індикаторного електроду та досліджуваним розчином з одного боку, та потенціалу другого електроду (електроду порівняння), що не залежить від активності (концентрації) іона натрію. Електрорушійна сила у елекричному колі, яке складається з індикаторного (натрієвого) електроду, електроду порівняння (хлоросрібного) та досліджуваного розчину, де визначається вміст іонів натрію, залежить від активності іонів натрію та температури (рівняння Нернста):
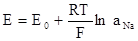
де Е - електрорушійна сила;
Е 0 - нормальний потенціал скляного електроду;
R - універсальна газова константа;
Т - абсолютна температура;
F - число Фарадея;
а Na - активність іонів натрію у досліджуваному розчині.
Необхідні хімічні реактиви та обладнання:
розчини хлориду натрію розведенням 0,1н фіксанального розчину NaCl в 10, 100 та
1000 разів;
фотометричний прилад
Na - селекційний електрод;
Na-селективний електрод.
Х і д а н а л і з у.
1. Приготувати стандартні розчини хлориду натрію розведенням 0,1н фіксанального
розчину NaCl в 10, 100 та 1000 разів.
2. Виміряти потенціал Na - селекційного електроду у цих розчинах та побудувати
графік залежності у координатах Е - Ina.
3. Виміряти потенціал Na-селективного електроду досліджуваної проби води, та
визначити вміст іону натрію за графіком.
Date: 2015-07-27; view: 451; Нарушение авторских прав