
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 6
|
|
Усувана твердість води, визначення хлоридів-
Тимчасова (усувана) твердість води
Необхідні хімічні реактиви та обладнання:
розчин соляної кислоти
метиловий оранжевий
дистильована вода
хімічна пробірка
конічна колба 200 мл
мірна колба 100 мл
фільтрувальний папір
Х і д а н а л і з у. Одну порцію досліджуваної води (50мл) тітрують розчином соляної кислоти у присутності метилового оранжевого, визначаючи загальну лужність. Другу порцію води (100мл) кип‘ятять 15 хвилин, охолоджують та фільтрують у мірну колбу, ємністю 100мл, розводять до мітки дистильованою водою, перемішують та фільтрують у чисту суху колбу. 50 мл фільтрату тітрують соляною кислотою у присутності метилового оранжевого, визначаючи залишкову лужність.
Тимчасову (усувану) твердість розраховують за формулою:
Т.тв. = 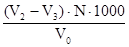 (мг-екв/л)
(мг-екв/л)
де V2 – об‘єм розчину соляної кислоти, витраченого на тітрування загальної лужності, мл;
V3 - об‘єм розчину соляної кислоти, витраченого на тітрування. залишкової
лужності,мл;
N- нормальність розчину соляної кислоти;
V0 - об‘єм води, що тітрувалась, мл;
Визначення хлориду
Найчастіше галогениди визначають за методом Мора - тітруванням розчинною сіллю срібла. При цьому утворюється нерозчинний осад галогениду (хлориду) срібла за реакцією
Cl- + Ag+ → AgCl
білий осад
Реакція йде до повного зв‘язування іонів хлориду, а перша крапля надлишку розчинної солі срібла реагує з індикатором - хроматом калію (K2CгO4), що утворює бурий осад Ag 2CгO4.
Необхідні хімічні реактиви та обладнання:
розчин K2CгO4
розчин азотнокислого срібла (AgNO3)
дистильована вода
хімічна пробірка
конічна колба 200 мл
Х і д а н а л і з у. До 10 мл досліджуваної води (якщо вміст хлориду передбачається великий, то беруть 2-5мл) додають 40 мл дистильованої води та 4 краплі розчину K2CгO4. Суміш тітрують розчином азотнокислого срібла (AgNO3) при постійному перемішуванні до появи незникаючого бурого відтінку.
Розрахунок [Сl -] = 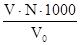 мг-екв/л . 35,5 мг/л.
мг-екв/л . 35,5 мг/л.
де V - об‘єм розчину AgNO3, витрачений на тітрування, мл;
N - нормальність розчину AgNO3;
V 4o 0 – об‘єм досліджуваної води, мл;
35,5 - еквівалентна вага іону Cl -.
Date: 2015-07-27; view: 347; Нарушение авторских прав